
苏欣 王焱
厦门大学附属心血管病医院
心血管疾病是威胁人类健康的“第一杀手”,位居全球死因首位。长期持续暴露于高水平的低密度脂蛋白胆固醇(LDL-C),会使动脉粥样硬化性心血管疾病(ASCVD)风险增高。既往多项研究证据表明:血浆LDL-C每降低1mmol/L,3年后ASCVD事件相对风险降低20%,随后每年降低1.5%,再次说明了降脂治疗是防治ASCVD的最重要环节之一。
2022年11月7日,美国心脏协会科学年会(AHA 2022)公布了正在进行的SHASTA-2研究的中期结果。值得注意的是,公布的结果说明靶向肝细胞载脂蛋白C3(APOC3)mRNA的siRNA制剂——ARO-APOC3能够大幅降低严重高甘油三酯血症(SHTG)患者血浆甘油三酯(TG)水平、非高密度脂蛋白胆固醇(non-HDL-C)水平和残余胆固醇水平,同时还能够显著升高高密度脂蛋白胆固醇(HDL-C)水平,充分提示该制剂在未来有望被应用于防治ASCVD。
对此,严道医声网特邀厦门大学附属心血管病医院王焱教授及其团队对SHASTA-2研究中期结果进行介绍及深入解读。

研究背景及研究方法
研究结果
该研究目前共招募了177名受试者,白人占89%,平均年龄约为55岁,女性占23%,基线水平中位TG介于643.9~708.5mg/dL,平均non-HDL-C介于191.7~212.1mg/dL,平均LDL-C 介于68.7~75.5mg/dL,平均HDL-C介于28.4~29.6mg/dL,各项参数在4组间基本达到均一。在第16周时,使用ARO-APOC3制剂显著降低了73%~87%的APOC3,78%~86%的TG(图1),34%~45%的non-HDL-C和69%~77%的残余胆固醇。同时,ARO-APOC3显著升高了76%~99%的HDL-C(图2)。上述分子水平在安慰剂组变化不大。然而,ARO-APOC3升高了11.6%~22.2%的LDL-C。
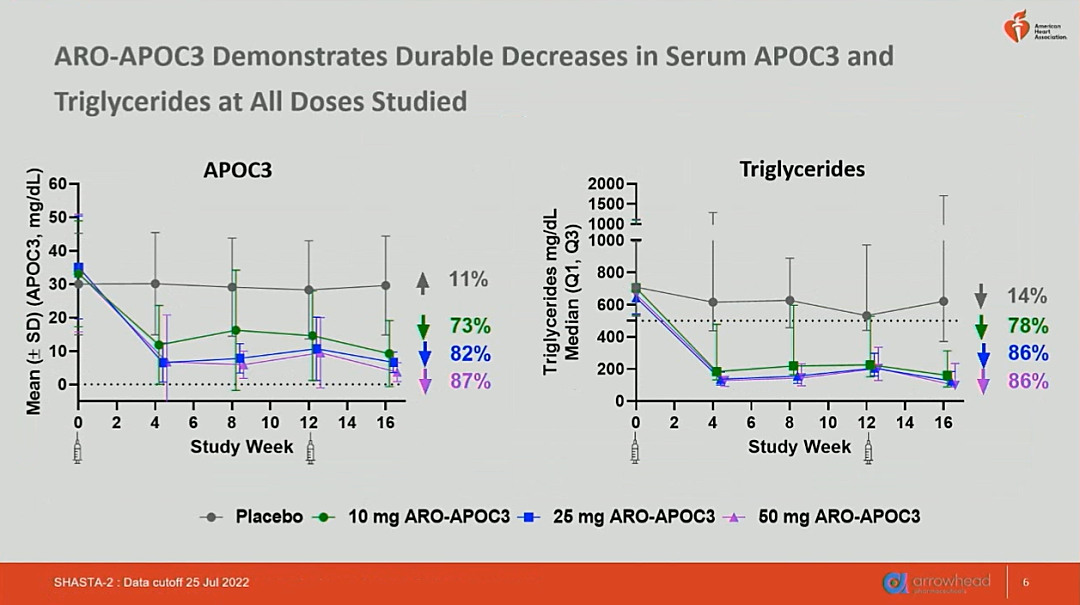
图1 研究至16周时受试者血浆APOC3、TG水平相比基线变化的百分比
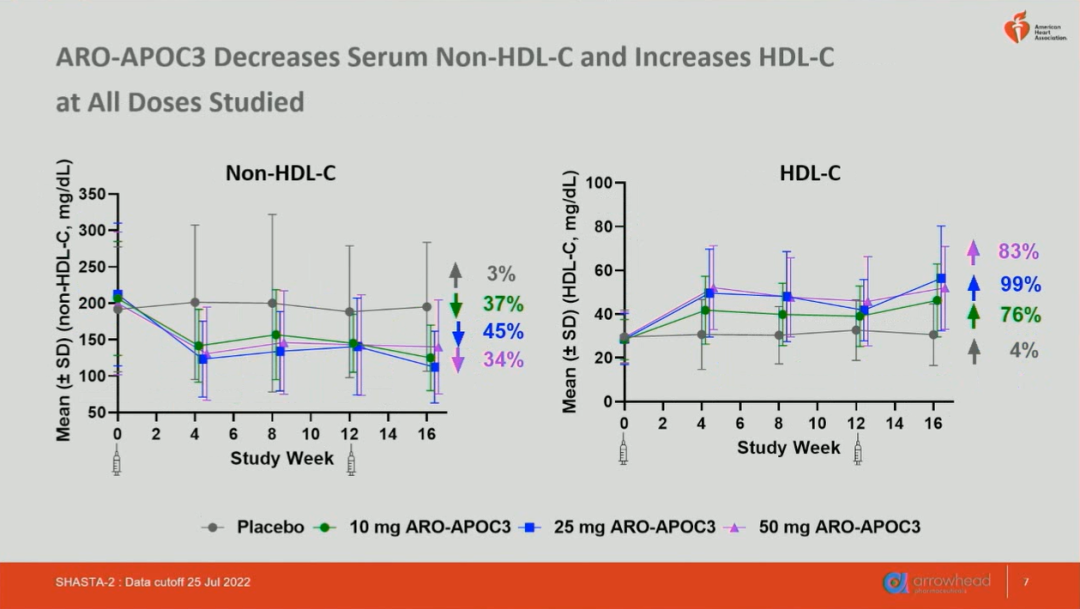
图2 研究至16周时受试者血浆non-HDL-C、HDL-C水平相比基线变化的百分比
值得注意的是,由于研究仍处于双盲阶段,药物安全性数据并未被分配到各组。在用药24周的77名受试者中,最常见的不良事件包括新冠肺炎(10%)、头痛(7%)和尿路感染(4%)。
研究结论
靶向肝细胞载脂蛋白C3(APOC3)mRNA的siRNA制剂——ARO-APOC3能够大幅降低严重高甘油三酯血症(SHTG)患者血浆甘油三酯(TG)水平、非高密度脂蛋白胆固醇(non-HDL-C)水平和残余胆固醇水平,同时还能够显著升高高密度脂蛋白胆固醇(HDL-C)水平,充分提示该制剂在未来有望被应用于防治ASCVD。但目前仍不能明确其对心血管疾病和急性胰腺炎风险的影响。
王焱教授点评
低密度脂蛋白(low density lipoprotein,LDL)及其胆固醇水平已经明确是ASCVD的重要致病因素之一。LDL在动脉壁内修饰、蓄积,导致动脉粥样硬化斑块的形成和进展,斑块侵蚀、破裂进一步引起心血管事件的发生[1,2]。因此,降低血浆低密度脂蛋白胆固醇(LDL cholesterol,LDL-C)是防控ASCVD风险的首要干预靶点,通过调脂治疗降低LDL-C并维持在较低水平,能够稳定和逆转斑块,从而降低ASCVD患者的心血管风险。
然而,近年来,越来越多研究提示包括TG、极低密度脂蛋白(VLDL)、乳糜微粒(CM)等因素可显著促进ASCVD进展。其中,SHTG是指患者空腹血清TG水平大于500mg/dL,通常由调控TG代谢基因的突变引起[3]。该病患者的心血管疾病风险和急性胰腺炎风险显著升高,且目前药物治疗效果有限,无法带来显著的心血管病时间获益。血浆APOC3是近年来广泛关注的载脂蛋白之一,在TG合成和代谢、ASCVD的发生发展中发挥重要作用。已有研究提示:APOC3突变和功能丧失的人群,血浆TG、CM、VLDL-C和残余胆固醇水平都显著降低,心血管疾病风险也相应下降。因此,已有观点将APOC3被视为治疗SHTG的关键靶点[4,5]。
ARO-APOC3制剂,是通过靶向降解肝细胞中APOC3的mRNA,以模拟AOPC3功能丧失的机体状态。目前已完成1项I期临床试验,除SHASTA-2外,针对混合性血脂异常患者的IIb期试验和针对家族性乳糜微粒血症患者的III期试验正在同步进行。与之前的研究结果一致,SHASTA-2表明ARO-APOC3也能够大幅降低患者血浆的TG、VLDL-C、CM和残余胆固醇水平,提示ARO-APOC3有可能进一步降低ASCVD发病率。
此外,该研究结果还提示,APOC3可大幅提高HDL-C水平,在缺乏APOA1的情况下促进HDL的从头生物合成。接受ARO-APOC3 25mg或50mg的受试者血脂降低水平在初次给药3个月内保持稳定,同ARO-ANG3一样证明了siRNA制剂的长效性,有利于提高患者依从性。然而,ARO-APOC3不仅不能降低,反而升高了LDL-C水平,提示靶向该分子不能很好地控制心血管疾病的主要风险,需要与降低LDL-C的靶向药联合使用。在用药安全性方面,截至目前,ARO-ANG3耐受性良好,出现16例干预相关的不良反应,但未报告因不良反应导致的研究终止。
本研究具有一定局限性,如种族多样性不足、性别比例失衡、各组样本量相对不足和缺乏亚组分析,需要在试验结束后详细评估。
专家简介
王焱
厦门大学附属心血管病医院
厦门大学附属心血管病医院院长,香港大学医学博士、教授、主任医师、博士生导师,美国心脏病学院会员(FACC),欧洲心脏病学会会员(FESC),国际心血管介入学会会员(FSCAI),中华医学会心血管分会委员,中国胸痛中心认证委员会副主任委员,中华医学会心血管病学分会介入心脏病学组副组长,海峡两岸医药卫生交流协会心血管病分会主任委员,国家卫生健康突出贡献中青年专家,具有丰富的临床工作经验,从事心血管系统疾病的诊治,在冠状动脉、外周血管疾病及心脏瓣膜疾病诊治方面有很高造诣。
门诊时间:周四下午
苏欣
厦门大学附属心血管病医院
医学博士,毕业于中南大学湘雅二医院,现就职于厦门大学附属心血管病医院。厦门市高层次卫生人才。擅长心衰、高血压、心肌病诊治和冠心病、心脏瓣膜病的微创介入诊治,美国心脏协会(ACC)FIT,Clinica Chimica Acta、Frontiers in Medicine杂志审稿人,主持多项省、市级课题,参与多项国家级课题,发表SCI论文近40篇,第一作者单篇最高因子12.76分。

