
2023年2月(总第5期)
作者:毛予、翟蒙恩、刘洋、杨剑
Highlight
本文亮点:

1)心脏瓣膜组织工程旨在提供具有再生能力和终身耐用性的活体自体心脏瓣膜植入物;
2)制造能够提供所需功能的仿生支架在力学性能和可调节孔隙度方面存在重要挑战;
3)熔融电铸技术可用于制造高度可调且空间异质性的纤维管状支架以用于心脏瓣膜组织工程。
////////////////////////////////////////
心脏瓣膜组织工程(HVTE)旨在提供具备再生能力和终身耐用性的自体心脏瓣膜植入物[1,2]。然而,制造能够提供所需功能的仿生支架仍然存在不少挑战,尤其体现在力学性能和可调节孔隙度方面[3]。通过开发创新平台和定制的控制软件,可实现具有特定架构(如可调位置、特定纤维图案和方向)及可定制几何形状的管状支架制造。本研究提出,使用熔融电铸(MEW)增材制造技术制作具有空间异质性的管状支架以用于HVTE。此外,交互界面可设定特异性支架区域,以获得应力应变曲线、瓣叶各向异性和软硬度以及它们之间的强化曲线边界等特性。然后,将异质管状MEW支架嵌入微孔弹性类重组体(ELR)水凝胶,以开发有利于细胞浸润和确保血液相容性的网络复合材料。从本文结果看,MEW/ELR复合材料的血流动力学功能已满足ISO 5840的要求。
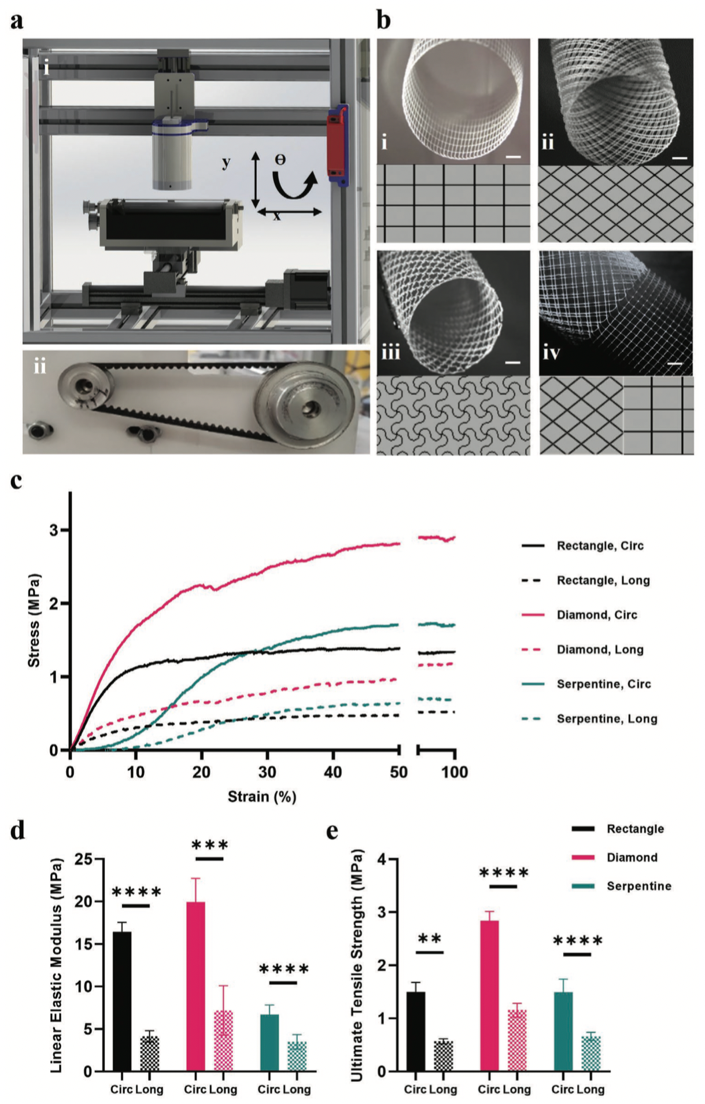
图1 a i)采用改进的芯轴收集器的MEW装置以制作3D模型;ii)采用2:1传动比的内部芯轴装置。b)单相支架:i)矩形;ii)菱形;iii)蛇形;以及iv)双相支架。c)各单相支架的应力-应变曲线。d)线弹性模量。e)各单相支架设计的极限抗拉强度。
接下来,开发出定制的G-code生成器,用于设计多相MEW支架,其设计参数包括瓣膜长度、直径、瓣叶尺寸等。同时,可进一步定义各模式下的参数(如孔隙和层数)。为验证新平台,MEW使用直径为22mm的芯棒成功制作了管状瓣膜支架以模拟测试其应力应变响应。瓣叶内的三角区域选择了菱形纤维设计是因为它比蛇形纤维具有更高的强度且可保持两个方向的顺应性。

图2 用于HVTE的空间异质性管状MEW支架的设计与制造。
最后,研究者通过将多相大孔MEW管状支架嵌入具有可控微孔隙度的重组弹性类基质以完成瓣膜结构的制作。根据ISO 5840标准,体外评估了复合MEW/ELR瓣膜的血流动力学性能,并通过高速摄像机显示主动脉瓣在心脏周期内开闭功能的正常稳定。

图3 a)复合MEW/ELR瓣膜制作示意图及其组成部件。b i)经ELR和致孔剂注射以嵌入MEW支架;ii)复合MEW/ELR瓣膜的光学图像;iii-iv)放大倍数增大时的SEM图像(其中iii为比例尺500µm, iv为比例尺50µm)。c)复合MEW/ELR瓣膜组件。d)循环测试复合MEW/ELR瓣膜的压力和流量状态。e)模拟循环系统功能测试时使用高速摄像机拍摄主动脉瓣开闭的图像。
结论与下步展望
生物心脏瓣膜作为一种常见的替代器官,在治疗心血管疾病方面发挥着很大作用,但目前传统方法制备的心脏瓣膜的只能维持有限的年限,而二次甚至多次更换难免增加对患者伤害的风险[4]。因此,生长型医用替代器官是未来医学界亟需攻克的方向。该研究采用的熔融电铸是一种先进的增材制造技术,能够沉积预定的微米级纤维,通过结合应用电场、温度和压力来实现带电熔融聚合物的喷射成形。与其他纤维形成技术(如传统电铸)相比,熔体电铸具有明显的优势,因为它能够制造出具有可调控机械性能、大孔径和图案的支架,用于广泛的应用,包括植入组织工程和疾病建模[5]。虽该研究结果令人鼓舞,但研究局限性在于该测试尚不能预测瓣膜的长期功能变化,为此需要进一步开展实验研究以评估支架性能。可以展望的是,该研究为心脏瓣膜生物打印领域提供了一个前沿方向,这可能为下一步组织工程应用铺平道路。

扫码查看原文

专家简介
杨剑
空军军医大学西京医院
西京医院心血管外科一病区主任,博士生导师。美国心脏协会专家会员(FAHA), 美国心脏病学会专家会员(FACC)。获聘陕西省中青年科技创新领军人才,陕西省科技创新团队带头人,为陕西省杰出青年科学基金项目获得者,获评第四届“国之名医”。研究领域包括心血管3D打印、新器械研发、应用转化及临床研究等,主编《心血管3D打印技术》等5部专著,在Eur Heart J,JACC等发表SCI论文100余篇。承担国家重点研发计划、国家自然科学基金等10余项课题,经费1000余万元。荣获国家科技进步二等奖、中华医学科技一等奖等多项奖励,授权国家专利30余项。
刘洋
空军军医大学西京医院
心血管外科博士,副主任医师,副教授,硕士研究生导师。微创结构性心脏病组组长,ECMO组组长。
美国马里兰大学医学院博士后。国家心血管病专家委员会微创心血管外科专业委员会委员。专注心血管疾病微创治疗。先后开展微创介入瓣膜病修复及置换术,瓣膜置换术后瓣周漏介入封堵术,冠状动脉漏介入封堵术等多项心血管疾病微创治疗新技术。在国内外发表研究论著70余篇,其中SCI论著28篇;主持军队重大专项子课题1项,国家自然科学基金1项,军队及省部级课题各3项;参加“863”重点课题,“十二五”、“十三五”国家重大科技专项等课题13项。获国家专利11项;主编专著1部,副主编专著3部,参编专著8部。获得省级科技进步一等奖1项,并先后获得美国ASAIO青年医师奖,欧洲Euro-ELSO青年研究者奖,中国医师协会心血管外科分会杏林奖,树兰卓越工程青年医师资助计划,中华医学会胸心血管外科分会Lillehei 奖学金及厄尔巴肯奖学金。现任中国医师协会心血管外科分会结构性心脏病专委会委员,中国研究型医院学会血管外科专委会青年委员,陕西省药理学会心血管药理学专业委员会常委,陕西省生物医学工程学会体外循环专业委员会委员,中国医疗保健国际交流促进会心脏重症分会陕西省工作委员会委员。

