

经导管三尖瓣介入治疗在亚太地区正在稳步发展。在过去十年中,亚太地区的临床医生使用了多种新型三尖瓣介入技术。目前尚未确定一种标准化的临床流程来诊断症状性三尖瓣反流,以增加患者获得新型介入治疗的机会。亚太地区患者人群的解剖结构多样性、疾病流行模式以及社会经济、文化和当地卫生政策,为治疗右心衰竭患者带来了独特挑战。随着右心衰竭和三尖瓣介入技术的不断进步,希望未来能有更多患者在亚太地区乃至全球范围内得到治疗。近日,香港中文大学威尔斯亲王医院苏泽宇教授等专家携亚太地区结构性心脏病专家在《JACC: Asia》杂志预发表了最新综述《Current Status of Tricuspid Valve Interventions in Asia Pacific Region》,该最新综述总结了三尖瓣介入治疗的最新进展及亚太地区三尖瓣介入的发展动态,值得各位同道重点关注。

复制链接阅读原文:
https://www.jacc.org/doi/10.1016/j.jacasi.2024.10.008
引言
有症状的重度三尖瓣反流( tricuspid regurgitation,TR)对患者和社会均产生重大的影响。在亚太地区,由于手术风险高(死亡率为8%-10%),单纯TR很少进行外科手术。对于不适合外科手术的TR患者,有必要进行介入治疗。二尖瓣介入治疗机制十分复杂,而在三尖瓣领域则更为复杂。右心具有非管状的多腔室解剖结构,三尖瓣介入技术需要专门的锚定结构、瓣周防护装置以及新型输送方法到达着陆区。在本综述中,我们旨在总结三尖瓣介入治疗的最新进展,特别关注亚太地区的发展动态。
疾病负担
在亚太地区,TR的发生率与欧美报告的登记数据相似(中心图示)。在美国,中重度TR的发生率估计为0.55%,女性和老年人群中的发生率更高。在中国一项31,499人的全国性调查中,TR的发生率为0.8%。中国DVD(China ElDerly Valve Disease)研究评估了8,929名60岁以上的住院患者,发现单纯TR是第二常见的原发性心脏瓣膜病(占16.5%,仅次于二尖瓣反流的26.9%)。在韩国一项4,089名患者的医院登记数据中,三尖瓣疾病是第三常见的心脏瓣膜病(占28.6%的患者)。一项2019年日本人群回顾性分析发现,在203,398名心脏瓣膜病患者中,三尖瓣疾病在总体发生率中排名第三(占22.9%;二尖瓣疾病占49.0%,主动脉瓣疾病占44.9%,肺动脉瓣疾病占2.2%,14.9%的患者有1种以上瓣膜功能异常)。Gossl等在一项基于社区的前瞻性研究中发现,16%的65岁及以上患者之前未诊断出中重度心脏瓣膜病;其中,TR占这些患者的7.2%。因此,社区中TR的真实发生率尚不清楚。

TR与发病率和死亡率增加有关。UK Biobank数据显示,与无TR的患者相比,TR患者的全因死亡率风险高出2.5倍。亚太地区关于TR的结局数据有限。Yang等的一项研究发现,中国左、右心多瓣膜心脏病患者的生存率因初次瓣膜手术时的手术矫正程度而异。在左心瓣膜病外科手术时同时接受干预以矫正严重TR的患者,其生存率高于外科手术未治疗TR的患者(外科手术时左、右心瓣膜干预的存活率为82.02%,而仅接受左心瓣膜干预的存活率为71.00%;P=0.048)。Fujisawa等的另一项分析发现,在2,211名日本患者中,房颤诊断时的TR严重程度是随后因心力衰竭住院的相关预测因素。这些发现表明,需要研发三尖瓣介入治疗技术,以帮助这种通常被拒绝进行外科手术的患者群体。
病因学
TR可表现出多种表型,其机制和病因各不相同。欧洲三尖瓣研究小组已对TR的分类进行了修订,将其细分为原发性TR、心房继发性TR、心室继发性TR和心脏植入式电子设备(cardiac implantable electronic device,CIED)相关TR。原发性或器质性TR由三尖瓣结构的解剖异常引起,包括黏液样变性、先天畸形、创伤性病变、风湿性心脏病和心内膜炎等亚类。继发性TR归因于右心系统因压力或容量超负荷而心腔扩大和右心功能不全所导致的瓣环扩张,可能与左心疾病引起的肺动脉高压或右心室压力正常的房颤有关,也可能在左心瓣膜手术后发生,有时在术后心肌顿抑、隐匿性右心室缺血性改变或亚临床右心瓣膜疾病致右心室重构情况下显露出来。TR可存在于左心室功能保留与否的情况下,这增加了右心衰竭分型的复杂性。CIED相关TR是一个独特的类型,由于正常三尖瓣瓣叶闭合平面的解剖改变,导致TR随时间进展,并可能出现右心衰竭。
要了解亚太地区TR的病因,需要了解社会经济决定因素和疾病病理生理学的流行情况(中心图示)。尽管风湿性心脏病发病率有所下降,但在一些亚太地区国家仍然是一个严重问题。在2015年全球疾病负担研究中,Watkins等报告称,全球超过70%的风湿性心脏病病例发生在印度(1317万例)、中国(707万例)和巴基斯坦(225万例)。Chan等还报告称,风湿性心脏病在毛利人、太平洋岛民和澳大利亚原住民等代表性不足的社区中存在显著的社会经济差异(北领地的北部地区[澳大利亚的一个自治领地]每1000人中高达15例)。风湿性心脏相关TR的机制复杂。它可以继发于左心疾病(即风湿性二尖瓣/主动脉瓣疾病)、风湿性心脏病本身相关的肺动脉高压,或罕见的三尖瓣的风湿性受累。此外,医疗资源获取的社会经济差异和遗传决定因素,会增加风湿热反复感染和风湿性心脏病进行性发展以及右心衰竭的风险。TR的其他危险因素还包括长期房颤。Patlolla等证明,在232例房颤患者队列中,随着时间的推移,近三分之一的患者发展为中重度的TR。Prapan等还发现,房颤患者中出现显著TR很常见,并且与不良结局独立相关。在《亚太心律学会2021年房颤筛查实践指南》中,Chan等报告称,在过去11年间中国房颤的发病率增加了20倍,并估计到2060年欧盟的房颤发病率将翻倍。他们还发现,亚太地区不同国家在筛查和检测房颤方面的实践模式存在差异。在基于人群、社区或工作场所的环境中,缺乏房颤和三尖瓣疾病筛查的统一标准,限制了症状性三尖瓣疾病的及时诊断和治疗。
三尖瓣的解剖与影像学评估
三尖瓣是心脏中最大的瓣膜,其正常瓣环面积在7至9cm²之间。一般来说,前叶最大,呈扇形结构,隔叶径向长度最小的,而后叶可能包含多个扇形结构,其总体环形周长最小。前乳头肌至关重要,因为它为前叶和后叶提供腱索。后乳头肌为后叶和隔叶提供腱索,而隔侧乳头肌则可能缺失。三尖瓣环具有复杂的三维结构,比二尖瓣环大约20%。为了辅助手术规划与实施,Hahn等根据超声心动图提出了三尖瓣的标准化命名和分类,将其分为6种类型/亚型:I型,3个叶;II型,2个叶;IIIA型,4个叶且其中2个为前叶;IIIB型,4个叶且其中2个为后叶;IIIC型,4个叶且其中2个为隔叶;以及IV型,超过4个叶。其中,I型是最常见的形态(53.9%),其次是IIIB型(32.1%)。
随着对三尖瓣介入治疗的需求增加,详细的经胸和经食管超声心动图(TEE)评估在评估TR和三尖瓣介入治疗可行性方面至关重要(图1)。重要的是量化TR程度、三尖瓣叶的形态以及TR的发病机制(图2)。需要进行二维和三维评估,以识别三尖瓣结构(三尖瓣叶、腱索、乳头肌或瓣环)是否存在由先天性或后天性因素引起的异常。如果没有发现器质性原因,则需要评估TR的继发性原因,进一步将病理生理机制分为心房继发性或心室继发性TR。
在心房继发性TR中,主要发病机制是由右心房扩大引起的三尖瓣环显著扩张导致的瓣叶闭合不良,这在长期存在房颤或射血分数保留的心力衰竭患者中最为常见。在心室继发性TR中,右心室的逐渐扩大导致三尖瓣叶牵拉和瓣环扩张,并伴有TR。与心室继发性TR不同,在心房继发性TR中,三尖瓣叶牵拉轻微,右心房与右心室不成比例地扩大,右心室锥形重构,右心室基底段明显增大(图3A和3B),并且在窦性心律或心率控制良好的房颤时,左、右心室功能通常保持正常。然而,患者同时出现心房和心室继发性TR特征的情况并不罕见(图3C)。
在CIED相关TR患者中,由于机制复杂和CIED电极造成的成像伪影,使用超声心动图进行评估颇具挑战性。CIED相关TR可能是由CIED电极与三尖瓣的机械相互作用(即三尖瓣叶撞击、瓣叶或腱索缠绕、腱索断裂、瓣叶粘连、瓣叶撕裂或穿孔)引起的,或由起搏相关TR引起的。最后,评估右心室功能和肺动脉压也很重要,这不仅有助于确定TR的机制,还有助于评估右心室功能(图1和2)。在大多数临床试验中,超声心动图估测的肺动脉收缩压>70 mmHg需进一步的有创检查,以评估是否存在未检测到的肺动脉高压。进行专门的右心导管检查以评估平均肺动脉压、肺动脉楔压和肺血管阻力,有助于预测患者接受三尖瓣介入治疗后的结局。评估左、右心室功能也很重要。在大多数三尖瓣临床试验中,左心室射血分数较低(<30%)的患者要么被排除在外,要么在考虑TR介入治疗之前,接受指南指导的药物治疗、经导管缘对缘修复(transcatheter edge-to-edge repair,TEER)、心脏再同步化治疗等。严重右心室功能不全的患者在接受三尖瓣介入治疗后(尤其是经导管三尖瓣置换术[transcatheter tricuspid valve replacement,TTVR]术,该手术通常可消除TR)可能更容易出现后负荷不匹配。因此,右心室功能不全的术前预适应和术后优化管理非常重要。



图3 CT三维重建显示心房与心室继发性TR
为了帮助多学科心脏团队筛选患者的解剖结构,以便评估采用潜在的TEER和置换技术的可行性,经食管超声心动图是必要的(图2)。根据目前的认识和临床经验,对于TEER,三尖瓣解剖结构可分为有利、可行或极具挑战性3类。有利的解剖学结构包括局限性脱垂/瓣叶连枷节、对合间隙<7mm、反流束起源于中央或前隔区、瓣叶-瓣环比≥1.06以及二叶或三叶形态。可行的解剖学结构包括对合间隙为7至10mm、反流束起源于后隔区、瓣叶-瓣环比<1.06、四叶形态、CIED电极且未导致瓣叶撞击或粘连。而极具挑战性的解剖学结构则包括对合间隙>10mm、反流束起源于前后连合、风湿性三尖瓣瓣叶改变(瓣叶回缩、钙化或瓣下结构钙化)、瓣叶穿孔、瓣叶显著牵拉、存在导致瓣叶撞击/粘连的CIED电极。最近,Gercek等进一步定义了GLIDE评分(对合间隙≥6mm、反流束位于后隔区/前后区/弥漫区、图像质量受限、密集腱索结构、TR形态呈星形)以预测经导管三尖瓣缘对缘修复的短期手术成功率。作者发现术前GLIDE评分为0-1的患者中,超过90%可实现TR减少≥2级和≤中度残留TR,而GLIDE评分≥4的患者中,这一比例仅为5.6%和16.7%。
术前心电门控增强CT对于规划三尖瓣介入手术(如TTVR术或瓣环成形术)具有价值(图2)。右心CT评估可实现针对特定患者的解剖学手术规划。CT通常用于评估患者解剖学结构是否符合手术要求,包括但不限于以下内容(图2):1)装置输送的血管通路;2)如果计划进行原位TTVR术,则评估三尖瓣瓣环尺寸;2)输送系统入口处的右心房和右心室长度及其用于装置导向的角度;3)术中透视的投射角度;4)如果计划进行异位瓣膜植入,则评估下腔静脉、上腔静脉尺寸;5)右冠状动脉相对于三尖瓣瓣环的位置,以便于选择瓣环成形装置。
临床表现与评估
重度TR患者可能在很长一段时间内未被发现,从而导致右心室逐渐扩张和功能不全。在左心瓣膜疾病(如二尖瓣反流和主动脉瓣狭窄)中,左心房压力升高和毛细血管后肺动脉高压表现为劳力性呼吸困难等症状。相反,在TR中,升高的右心房压力传递至全身静脉系统,导致心脏输出量减少和功能性降低的相对隐匿症状。TR患者通常不会出现明显的心脏杂音,即使在筛查超声心动图检查中偶然发现中重度TR,也往往没有典型的左心衰竭体征和症状。然而,如果患者出现明显的右心衰竭临床症状和体征,TR往往已进展至晚期,并可能伴有右心室重构。与欧美的注册报告类似,亚太地区的TR患者通常就诊较晚,且专科评估和手术或介入治疗的转诊也较晚。因此,亚太地区的大量患者在就诊时已出现较大的三尖瓣对合间隙和终末期右心室衰竭,这使得TEER在解剖学上充满挑战,且长期耐用性不确定(中心图示)。当前指南建议,应在终末器官损伤出现和显著右心室功能不全发生之前治疗原发性TR。最新的欧洲心脏瓣膜病指南建议,对于存在症状但无法手术,且解剖学上符合条件并可能从手术中获益的患者,可在有经验的心脏瓣膜中心进行继发性TR介入治疗。
对于出现症状的TR患者,建议进行全面评估(图1)。由结构性心脏介入、影像学、心脏外科、心力衰竭、心脏电生理、麻醉、重症组成的多学科心脏团队对于确定适当的治疗策略和优化TR患者的围手术期管理至关重要。为了指导适当的治疗策略,多学科心脏团队需要评估患者的症状、目标导向药物治疗、手术风险、发病机制、左右心功能以及肺动脉压力(通过经胸超声心动图进行,临界病例可通过右心导管术评估)。在临界肺动脉高压病例中,右心导管术尤为重要,因为它有助于阐明TR的机制、指导治疗的可行性,并预测三尖瓣介入手术的预后。
在亚太地区,需要根据每个国家特定的文化和社会经济因素来制定管理路径(图1)。在制定治疗决策时,考虑患者的偏好和当地卫生政策很重要。对于多学科心脏团队认为进行有创治疗无效的终末期心力衰竭患者,可考虑姑息治疗。对于可逆性继发性TR原因(如左心疾病、原发性肺动脉高压)的患者,应考虑治疗原发性疾病。在首次检测到有症状的重度TR时,应开始利尿治疗。如果患者在优化利尿治疗后仍有难治性症状,对于低手术风险患者,可考虑外科手术治疗。在高手术风险队列中,可根据患者的解剖学适宜性和当地医疗水平考虑三尖瓣介入治疗。详细的经食管超声心动图以及术前评估将有助于指导患者的个性化经导管治疗选择(图2)。心脏磁共振成像(cardiac magnetic resonance imaging,CMR)是目前量化右心室大小和收缩功能的金标准,如果条件允许,应考虑使用CMR来评估接受三尖瓣介入治疗患者的基线右心室功能和术后重构情况。多学科心脏团队在制定治疗决策时,需要考虑患者的长期抗凝耐受能力、经导管装置技术的获取情况、当地介入技术和成像专业水平,以及当地卫生政策,这些因素与患者和医院获取新技术的能力相关(图1)。最后,当患者不符合商业可用介入技术的解剖学标准时,通过临床试验获取新技术可能为没有其他治疗选择的患者带来新的希望。
干预措施
一、药物治疗
当前欧美指南建议对症状性TR进行利尿剂试验(IIa)。使用利尿剂旨在减少右心室和右心房的容量负荷,从而有助于缓解全身充血。随着三尖瓣介入治疗方案的快速发展,右心衰竭最佳指南指导药物治疗方案和三尖瓣介入治疗前最佳利尿剂剂量的数据很少。此外,新型心力衰竭药物(如钠-葡萄糖协同转运蛋白2抑制剂)因其对射血分数保留的心力衰竭患者的积极影响而受到广泛关注。当前正在进行的研究正在评估钠-葡萄糖协同转运蛋白2抑制剂对右心室功能、TR进展、心力衰竭住院率和心血管终点(Reduction-TR [SGLT2 Inhibitor for Severe Tricuspid Regurgitation; NCT05686616], PROVE [Pharmacological Reduction of Right Ventricular Enlargement; NCT04345796], EVENT [Enavogliflozin Outcome Trial in Functional Tricuspid Regurgitation; NCT06027307])的潜在影响,这些研究可能为确定TR的最佳目标导向药物治疗方案提供更多希望。
二、外科手术
在2021年欧洲心脏病学会/欧洲心胸外科协会指南中,建议对接受左心瓣膜手术的严重TR(原发性或继发性)患者(I类)、三尖瓣环扩张(>4 cm,IIa类)、症状性严重原发性单纯TR患者(IIa类)以及无肺动脉高压或左心疾病的症状性单纯严重继发性TR患者(IIa类)进行三尖瓣手术治疗。日本心脏瓣膜病指南也给出了类似的建议。一项美国研究对接受三尖瓣修复或置换手术的住院患者进行了分析,并根据三尖瓣手术干预类型确定了术后结局的趋势。与三尖瓣修复术(5.9%)相比,单纯三尖瓣置换术的院内死亡率最高(10.9%),且永久起搏器植入率也更高(35.0% vs 13.4%)。三尖瓣置换术与三尖瓣修复术死亡率差异的原因被认为具有多方面因素,可能包括外科医生可能选择为右心室情况更差、瓣环扩张更严重的患者使用他们认为耐久性更强的置换装置,而非修复策略,以及患者群体整体情况更差。在亚太地区,三尖瓣手术的趋势类似。在中国DVD研究中,只有3.2%的右心瓣膜病患者(主要是TR患者)接受了手术治疗,远低于左心瓣膜病患者。在日本,只有16.4%的患者接受了三尖瓣手术,远低于主动脉瓣狭窄患者(53.6%)和二尖瓣反流患者(38.3%)。其中,大多数是接受三尖瓣修复术(2015-2016年为12342/12647,2013-2014年为11469/11869),而非三尖瓣置换术(2015-2016年为305/12647,2013-2014年为359/11869)。三尖瓣外科手术干预数据存在较大差异。
大多数收集三尖瓣外科手术结果的注册数据并未区分不同类型的三尖瓣修复策略,即瓣环成形术、Kay缝合瓣环成形术、De Vega缝合瓣环成形术、三角形切除术或双孔瓣膜修复术。据报道,外科双瓣化成形术与瓣环成形术联合治疗在3年随访中可持续减轻TR程度。随着三尖瓣介入领域的发展,外科和介入技术将继续发展。
与西方国家不同,亚太地区国家获取心脏手术的机会存在巨大差异,这主要由社会经济状况的不同所导致。在欠发达的南亚国家,尽管总人口超过美国的6倍,但这些国家每年进行的心脏手术总数却不到美国的一半。另一方面,在日本等较发达地区,心脏手术并不罕见。此外,在亚太地区,大多数三尖瓣手术是作为多瓣膜手术的一部分进行的,最常见的是在二尖瓣手术期间进行三尖瓣瓣环成形术。在多瓣膜手术期间进行三尖瓣瓣环成形术是亚太地区心脏外科医生的基本技能,单独的三尖瓣手术很少实施。
三、介入治疗
有多种经导管三尖瓣介入治疗方法已商业化或正在开发中,包括介入修复和介入置换(见图4)。介入修复治疗包括瓣叶对合装置、瓣环成形术和其他装置如“间隔物”(填充对合间隙)。介入置换包括异位和原位瓣膜置换。然而,由于以下几个原因,亚太地区用于治疗TR的装置选择有限:1)不同国家/地区之间的装置监管流程和装置报销政策存在显著差异;2)主要心血管装置公司在亚太地区的市场优先级较低,这导致新装置在亚太地区的上市时间晚于美国和欧洲,并排除了亚太地区使用研究性装置的机会;3)装置创新缺乏,直至最近,更多新型装置研发才开始源自亚太地区国家。目前,TEER装置TriClip已在亚太部分地区获得商用批准(包括但不限于香港、台湾、泰国、马来西亚、新加坡),而更多经导管缘对缘TR修复装置正处于临床研究阶段(见表1)。因此,我们重点回顾在亚太地区已商业化或已在研究中使用的装置特征和证据(见图4)(包括TEER装置[TriClip(Abbott)和DragonFly(Valgen Medtech,德晋医疗)]、TTVR装置[Lux Valve Plus(Jenscare,健世科技)、CardioValve(Venus Medtech,启明医疗)和TricValve(P&F Products & Features)]以及局部瓣环成形术装置K-Clip[Huihe Medical,汇禾医疗])。

图4 亚太地区当前经导管三尖瓣装置概览

1.三尖瓣TEER
迄今为止,三尖瓣TEER仍是亚太地区最常见的经导管三尖瓣修复手术。目前,有两种装置(Abbott的TriClip和Edwards Lifesciences的PASCAL Precision)已在欧洲获得商业使用批准,TriClip装置也在美国上市。在TEER治疗中,通过反流部位的瓣叶对合来解决TR,从而改善瓣叶闭合并减小反流面积。
专门设计的TEER系统TriClip(Abbott Vascular)具有较短的引导导管弯曲度和可操控的运动平面(室间隔-侧壁平面),便于同轴进入三尖瓣。第四代TriClip系统(Abbott Vascular)最近在部分亚太地区推出(表1)。第四代TriClip系统具有4种不同长度和宽度的夹子(XTW、XT、NTW和NT),并通过可控抓握器驱动来实现优化的瓣叶抓取。三尖瓣TEER装置的有效性和安全性已通过单臂研究和随机对照试验(TRILUMINATE)得到证实。TRILUMINATE(TRILUMINATE Study With Abbott Transcatheter Clip Repair System in Patients With Moderate or Greater TR)试验显示,在1年随访中,两组间的死亡或三尖瓣外科手术率以及因心力衰竭住院率似乎没有差异。然而,与对照组相比,TEER组的KCCQ评分提高,平均提高12.3±1.8分,而对照组仅提高0.6±1.8分(P<0.001)。此外,bRIGHT(An Observational Real-world Study Evaluating Severe Tricuspid Regurgitation Patients Treated With the Abbott TriClip Device; NCT04483089)真实世界注册研究也显示,与基线相比,接受TriClip治疗的患者在1年时NYHA心功能分级显著改善(从21%到75%为I/II级;P<0.0001),KCCQ评分平均提高19±26分(P<0.0001)。此外,最新的Tri.Fr随机对照试验显示,在重度症状性TR患者中,与仅采用指南指导的药物治疗(Guideline-directed medical therapy,GDMT)相比,采用TriClip进行TEER加GDMT在12个月时实现临床复合评分改善方面更优(74.1% vs 40.6%,效应估计值为0.67,95% CI:0.61-0.72;P<0.0001),其中包括NYHA心功能分级改善、患者生活质量评估以及主要心血管不良事件发生率。积极结果主要归因于症状和生活质量评估的改善,而在主要心血管不良事件和心血管死亡率方面没有显著差异。由于入组前患者要么左心室收缩功能正常,要么左心室收缩功能受损且已接受最大剂量的GDMT,因可能需要更长时间的随访来评估这些临床硬终点。此外,该研究还再次证实,三尖瓣TEER与较低的院内并发症发生率(8%)相关,且院内死亡率为0.6%。TriClip于2024年4月获得FDA批准。
PASCAL装置和输送系统是一种镍钛合金装置,具有被动闭合机制。它可用于二尖瓣和三尖瓣TEER,能够实现联合手术。与TriClip系统不同,PASCAL具有一个中心垫片,两个夹子收拢捕获瓣叶,中间的垫片能够很好的填充间隙以减少TR。该装置具有独特的伸长设计,可最大限度地降低瓣叶缠绕的风险。该装置有两种尺寸可供选择,并且可操控导管中集成了连续压力监测功能。早期使用PASCAL系统的经验显示,在30例患者中,有86%的患者在1年时TR持续减少至中度或以下。正在进行的CLASP TR pivotal试验将患者随机分配至GDMT组和PASCAL系统TEER组,随访期为2年。在亚太地区,PASCAL装置目前已在澳大利亚和日本上市,用于治疗二尖瓣反流,但尚未用于治疗TR。
Dragonfly系统是中国自主研发的TEER装置。该装置具有一个中心可压缩填充物,可以压缩至不同角度,并且夹臂可在0°至45°锁定以填充残余反流口,从而可能降低瓣叶张力。该装置有4种不同尺寸。Dragonfly已在中国获批用于治疗二尖瓣反流,目前正在进行TR治疗的临床试验。
2.TEER术步骤详解
TEER手术是在透视和TEE引导下通过股静脉通路进行的,大多数情况下在全麻下进行(见图5)。输送鞘管的导向旨在使夹子在目标区域与瓣叶闭合线垂直对齐,此过程通过TEE进行指导。对于存在较大对合间隙的情况,可采用其他技术来减小对合间隙,以便夹持瓣叶,这些技术包括利尿、Valsalva动作、使用呼气末正压,或通过将手术床倾斜10°的Trendelenburg体位。
TEER的其他方法(如采用“拉链”技术)已证实能有效减少了TR,该技术在第一枚植入物之后同时使用多个夹子,从更靠近瓣叶交界的位置开始,沿着瓣叶对合平面进行“拉链式”夹持(从边到中),以便于后续的夹持操作。前间隔和后间隔瓣叶尖端夹持可以获得最大的心输出量增加,因为这些特定瓣叶组合的对合面积能够有效增加。

图5 使用TriClip装置进行三尖瓣TEER术的过程图像
3.瓣环成形术
瓣环成形术的潜在优势是包括保留了瓣叶解剖结构,并可作为其他干预措施(如瓣环成形术联合TEER术)的辅助手段。Cardioband系统(Edwards Lifesciences)类似于外科成形环,目前已获得CE认证。Cardioband通过股静脉植入,通过TEE的指导下,使用多个锚定螺钉来缩小三尖瓣环并减少TR。在一项纳入37例患者的多中心早期可行性研究中,手术成功率为83%,一年随访时,73.1%的患者TR分级降低≥2级,73.0%的患者残留TR为中度或以下。此外,从基线到一年,NYHA心功能I/II级患者的比例翻倍,KCCQ评分也有显著改善(提高19.0分)。TRI-REPAIR(TrIcuspid Regurgitation RePaIr With CaRdioband Transcatheter System)观察性研究纳入了30例有症状的功能性TR患者。两年随访时,超声心动图显示隔侧瓣环直径减少了16%,72%的患者TR≤2+。6分钟步行距离和KCCQ评分分别提高了73米和14分。然而,由于植入过程复杂,手术和透视时间长,该装置目前仅限于少数经验丰富的中心使用。
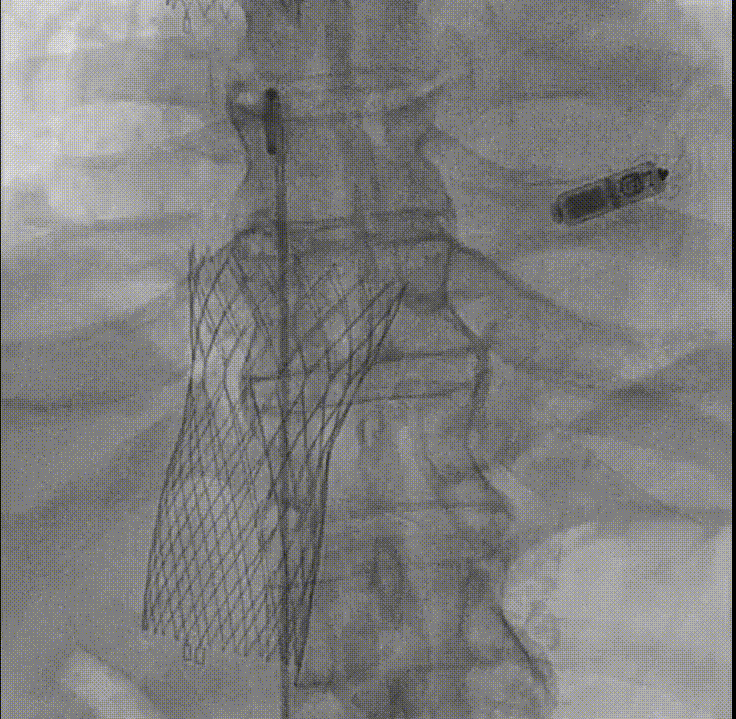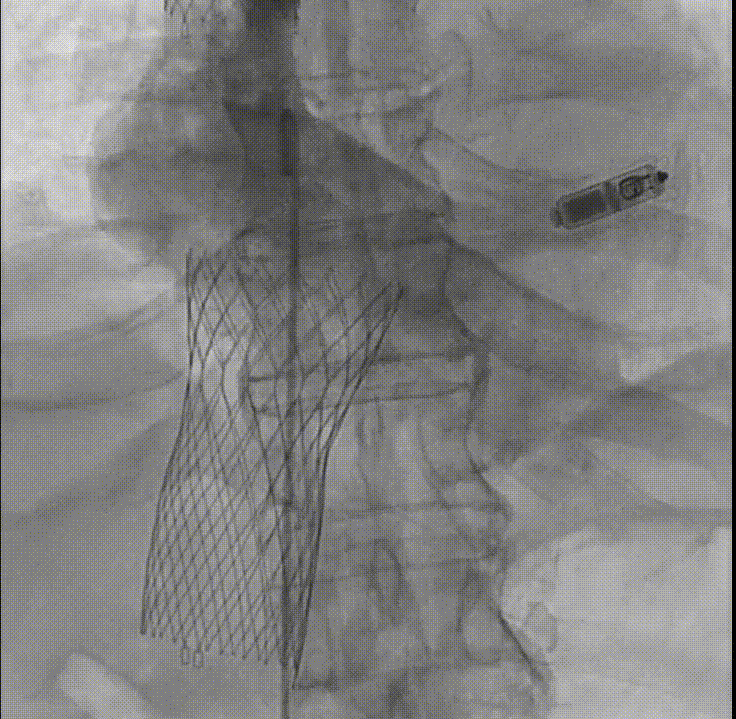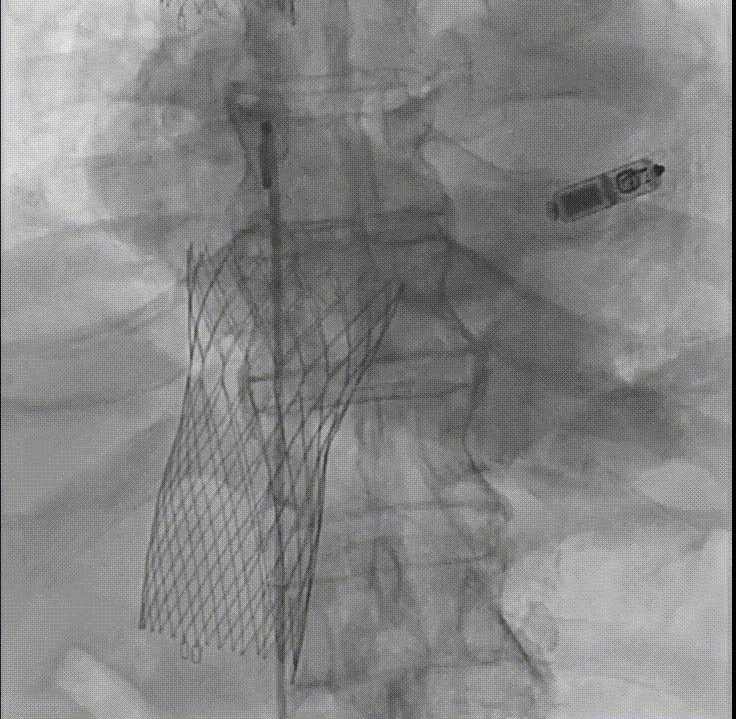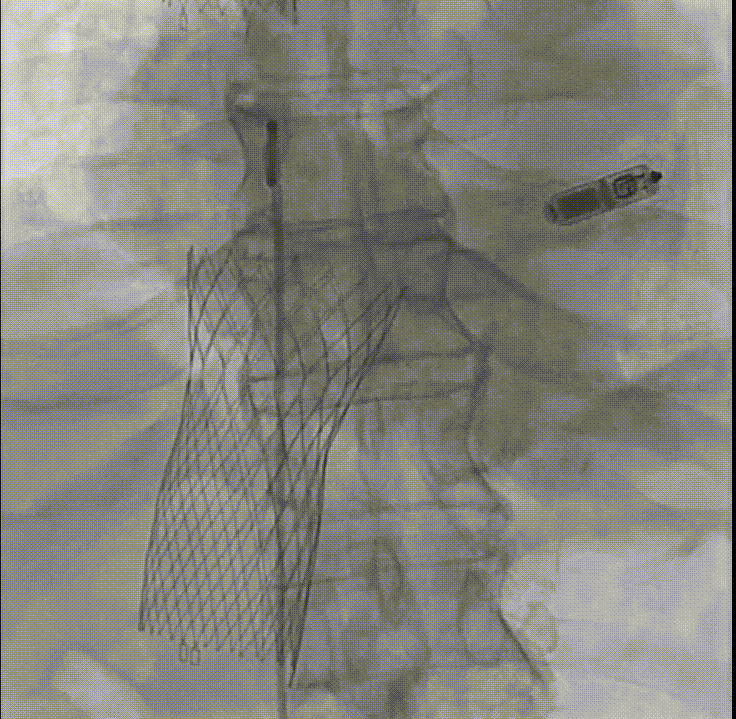
K-Clip(Huihe Medical,汇禾医疗)是一种经右颈内静脉输送的局部瓣环成形术装置(见图6,视频1)。它通过改良的经导管三尖瓣瓣环成形术路径,模拟Kay双瓣化手术,实现三尖瓣环缩小和TR减少。K-Clip输送鞘管对准目标三尖瓣环交界区,采用专有的螺旋锥技术,在K-Clip夹内捕获并收回三尖瓣环的目标部分,从而实现夹合、假性二尖瓣化、贴合对位以及缩小三尖瓣环。TRISTAR前瞻性注册研究纳入了39例TR患者,结果显示,所有患者均成功植入了K-Clip,每例患者植入1至3个装置,100%的患者TR分级至少降低1级,并在30天时伴随患者生活质量的改善(6分钟步行距离增加78米,堪萨斯城心肌病问卷评分提高11分)(表1)。

图6 多模态成像引导K-Clip经导管瓣环成形术
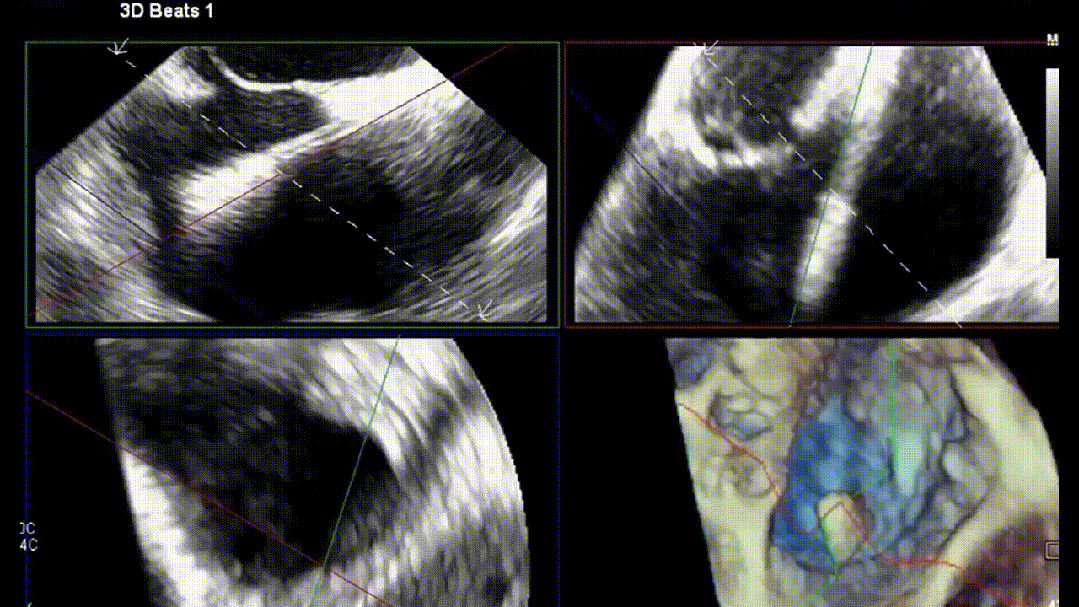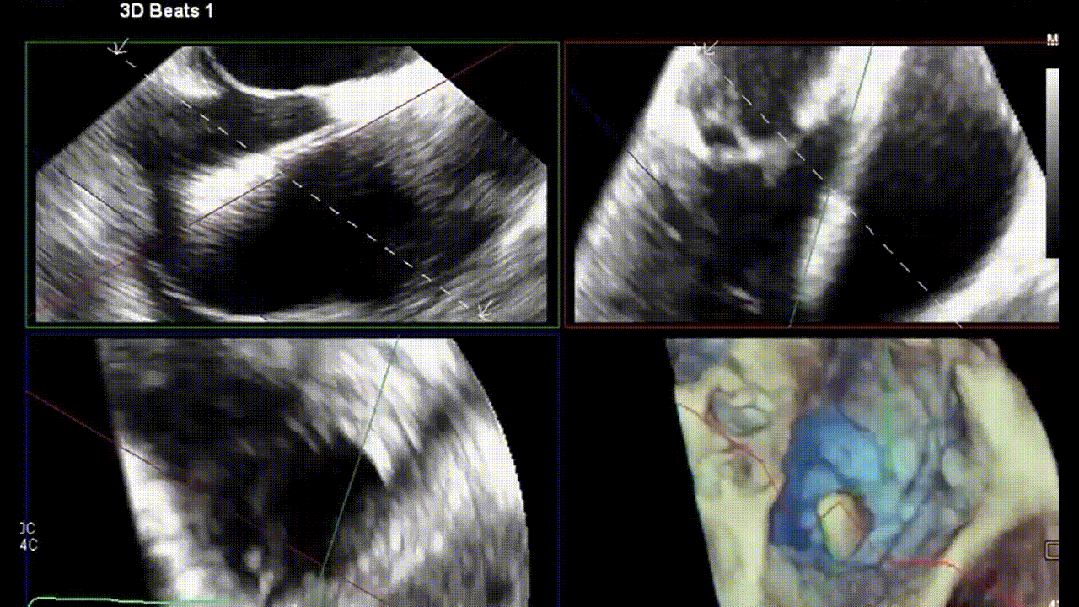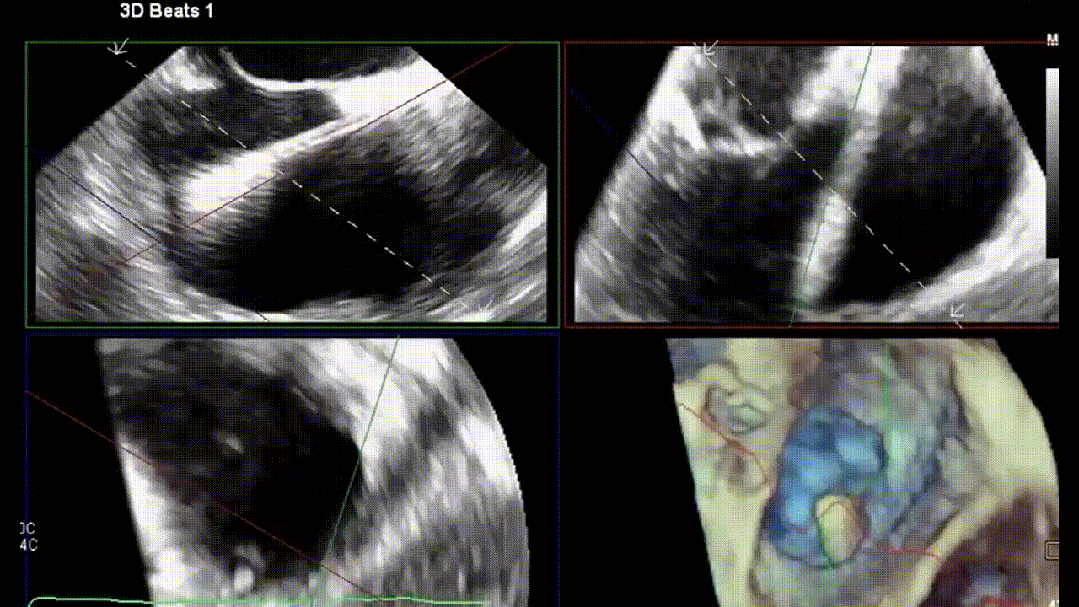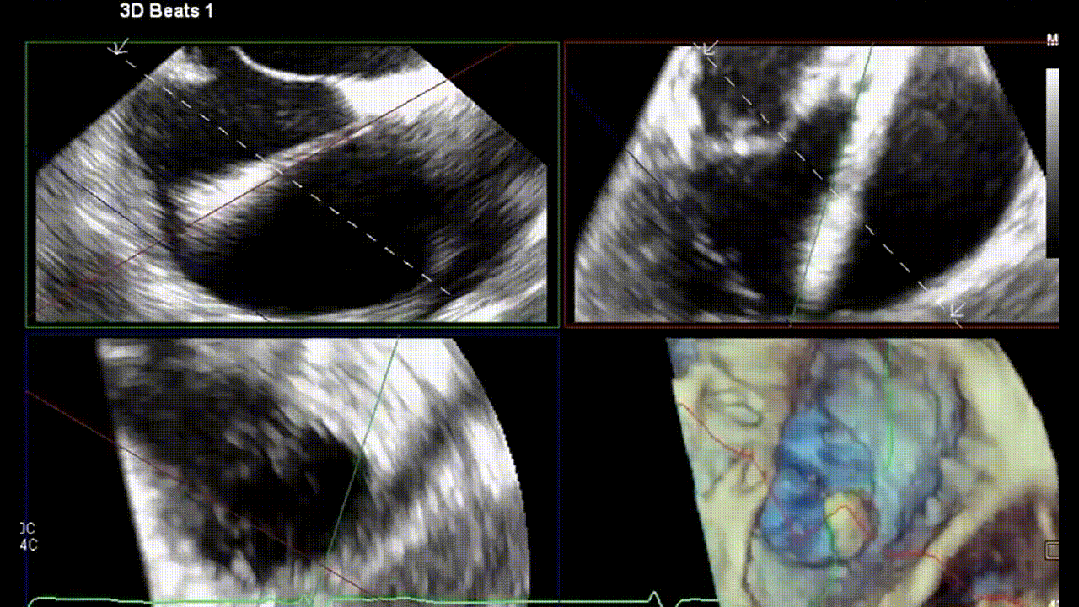
4.原位TTVR术
目前,某些亚太地区已有专门用于原发性TR的TTVR术装置。Evoque系统(Edwards Lifesciences)是一种自膨胀装置,采用瓣叶和瓣环混合固定方式,并配有专用输送系统,是可用于商业用途的首批TTVR术装置之一。该系统已在欧洲和美国获得商用批准,在日本处于研究性试验使用阶段,并预计最早将于2025年在有限的亚太地区提供商用。该装置通过股静脉通路输送,在全麻和术中TEE引导下进行。TRISCEND(Edwards EVOQUE Transcatheter Tricuspid Valve Replacement: Pivotal Clinical Investigation of Safety and Clinical Efficacy using a Novel Device)研究纳入了176例患者。超过97%的患者TR程度降低至轻度或以下(P < 0.001),93.3%的患者达到NYHA心功能I级或II级(P < 0.001)。30天心血管死亡率为1.7%,1年全因死亡率为9.4%。比较Evoque TTVR术与药物治疗的TRISCEND II试验已完成,其良好的6个月结局使得产品最近获得了FDA批准。
还有其他几种TTVR装置正处于临床试验阶段或在亚太地区部分选定地点获得同情使用批准(表1)。Lux Valve(Jenscare,健世科技)是由中国自主研发的TTVR装置。该装置最初是通过右侧小切口经心房途径,使用微创外科技术植入的。LuX瓣膜具有三种锚定结构:两个夹持件,一个用于捕获前瓣叶,另一个用于捕获后瓣叶;还有一个室间隔锚定件部署于室间隔中部,利于瓣膜锚定和稳定性。此外,LuX瓣膜还具有独特的设计,其自适应心房盘片袖套延伸并紧贴右心房壁,以减少瓣周漏。第二代Lux Valve Plus系统通过右颈内静脉通路输送(见图7,视频2)。该装置目前正在欧洲进行临床试验,并在中国进行研究性试验。CardioValve(Cardiovalve Inc)是一种TTVR系统,具有额外的密封袖套,以最大程度地减少瓣周漏(表1)。
其他尚处于早期研究阶段且尚未在亚洲上市的器械包括Intrepid(Medtronic Inc)、VDyne(VDyne)、Topaz(tricuspid regurgitation iCares SAS)、TriSol Valve (TriSol Medical Ltd)和Duo Valve (Croivalve)。

图7 多模态成像指导LuX TTVR术

5.异位TTVR术
腔静脉瓣植入术已被用于有常规经导管介入治疗解剖学禁忌证的患者,以保护器官免受静脉高压,并减少TR。TricValve(P&F Products & Features)是一种通过股静脉通路输送的异位双瓣腔静脉瓣(见图8,视频3)。TRICUS/TRICUS EURO研究的综合分析纳入了44例严重症状性TR患者。在TricValve植入术后1年的随访中,95.5%(44例中的42例)的患者KCCQ评分从基线增加≥15分、NYHA心功能分级改善至I级或II级,或6分钟步行测试距离增加≥40米。接受TricValve植入术的患者在6个月随访CT中,右心室中部直径从48.6±9.9毫米减少至43.0±7.3毫米(P=0.001)。TricValve具有两个专用的自膨胀镍钛合金支架和牛心包瓣叶,分别植入下腔静脉和上腔静脉,以消除系统性静脉淤血。植入术可以在纯透视引导下进行,也可以辅以经胸超声心动图和TEE引导。
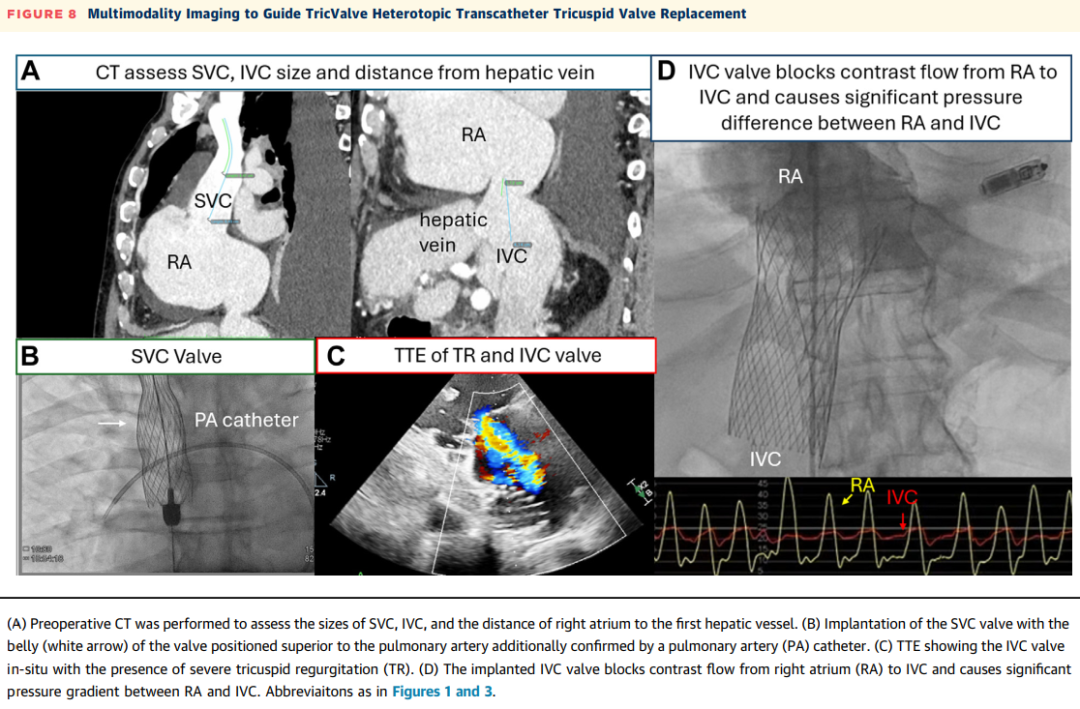
图8 多模态成像引导TricValve异位TTVR术
6.术中影像引导
在进行TR介入治疗时,介入医师的专业知识至关重要。术前CT用于器械选择和解剖测量。除标准透视外,术中三维经食管超声心动图(3D-TEE)是介入医师最常用的成像方式。影像医师与植入医师之间清晰顺畅的沟通对手术成功至关重要。使用实时三维多平面重建成像来优化输送系统的轨迹,确定三尖瓣叶与特定器械捕获机制之间的关系。常见的成像方案包括使用多平面重建(MPR)成像和经胃底短轴切面(见图5)。经胃底短轴切面(约30°)用于辅助TEER术中夹子的目标区域定位。此视图有助于显示所有三尖瓣叶,定位瓣叶对合间隙和反流射流起源。最重要的是,此视图能够持续监测夹子臂的方向,以保持其与对合线垂直。
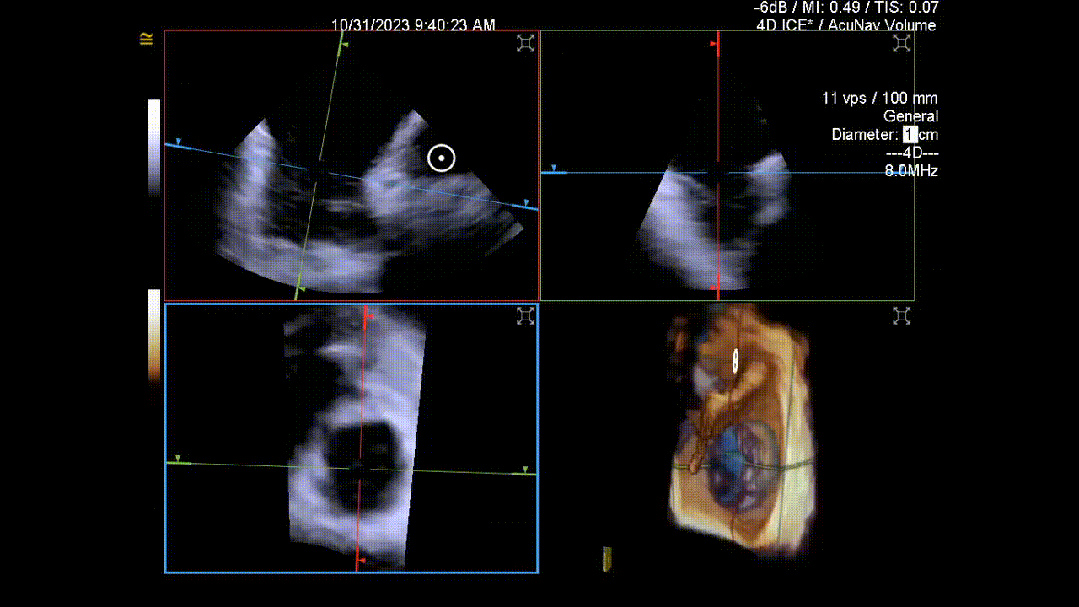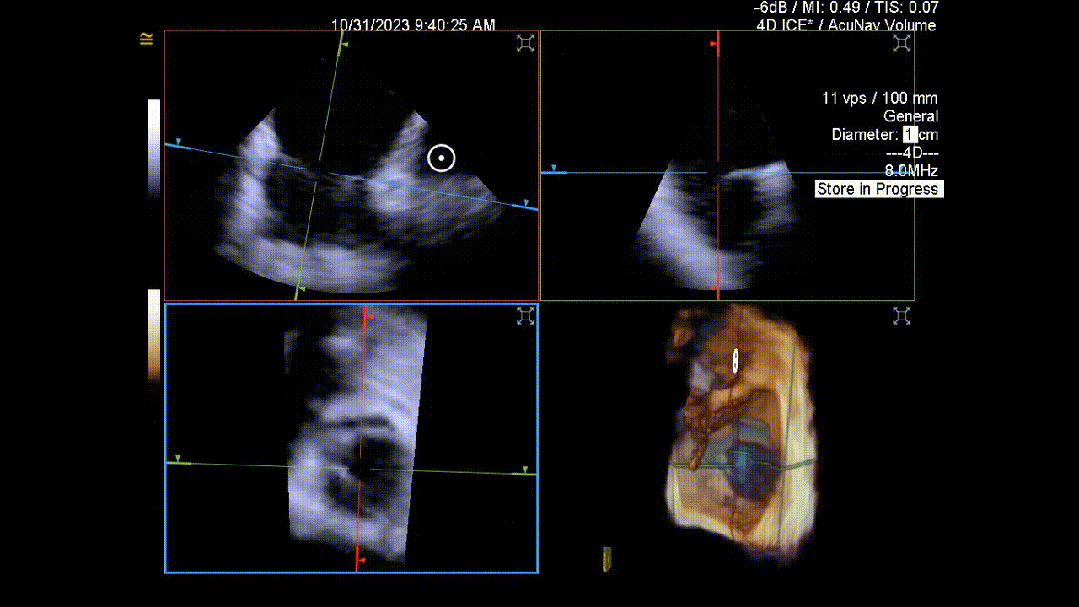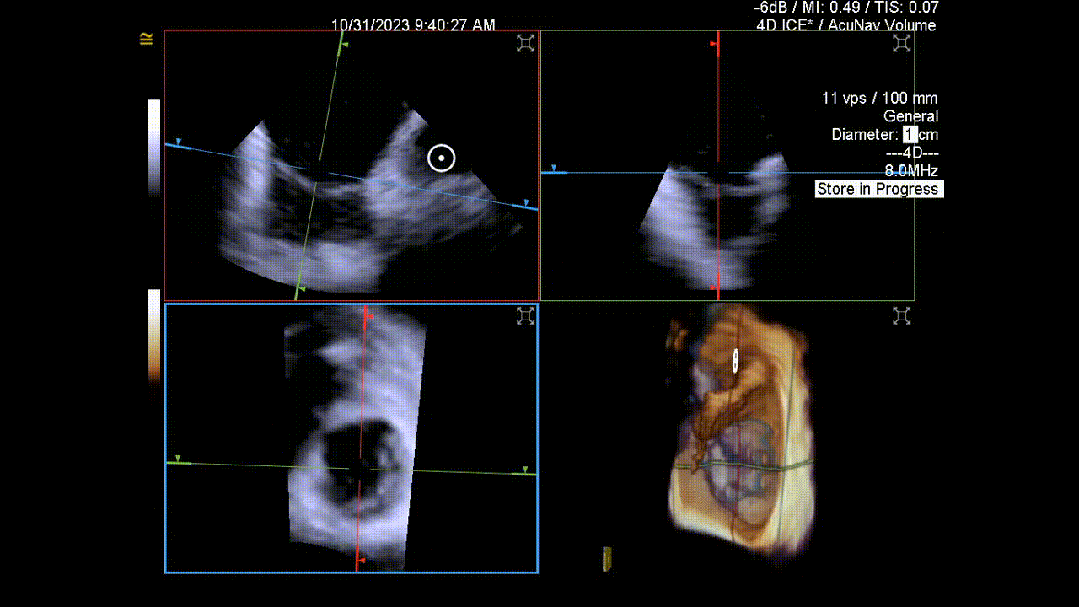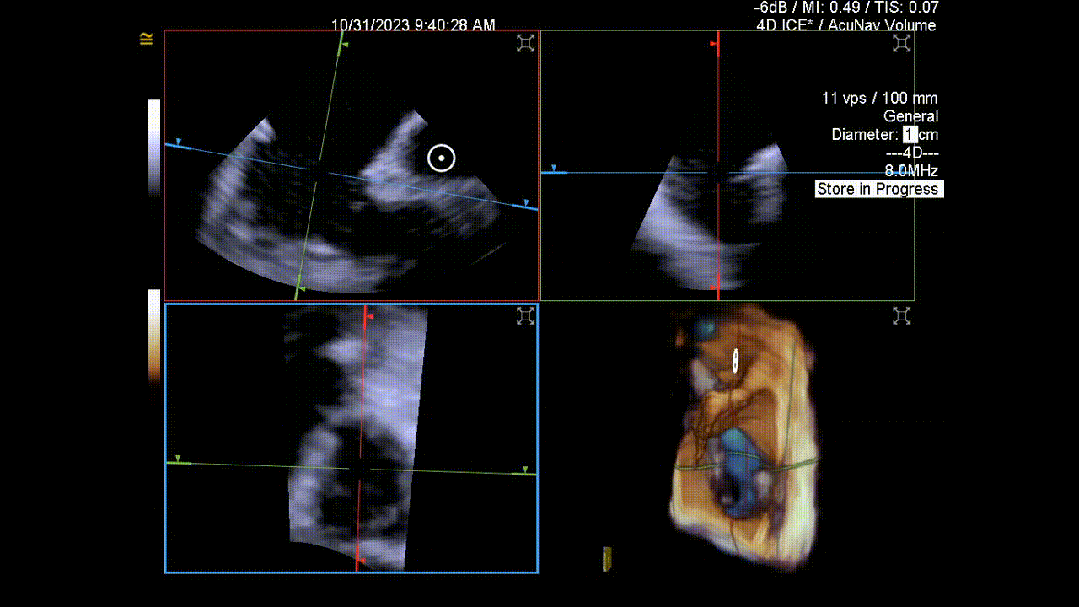
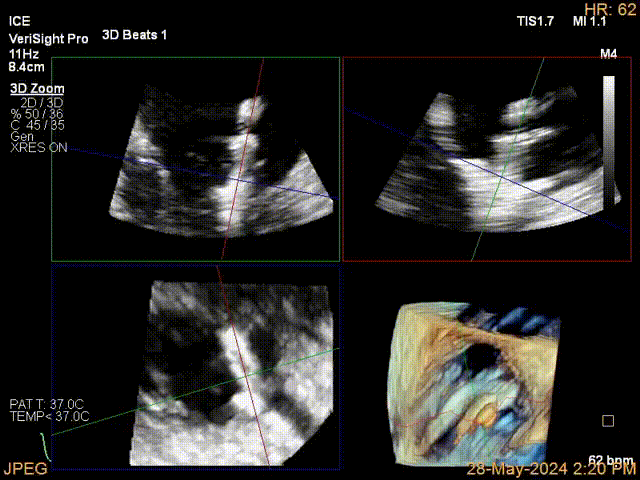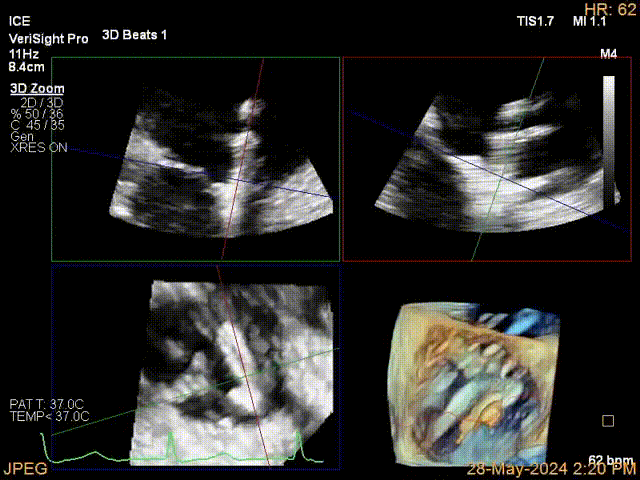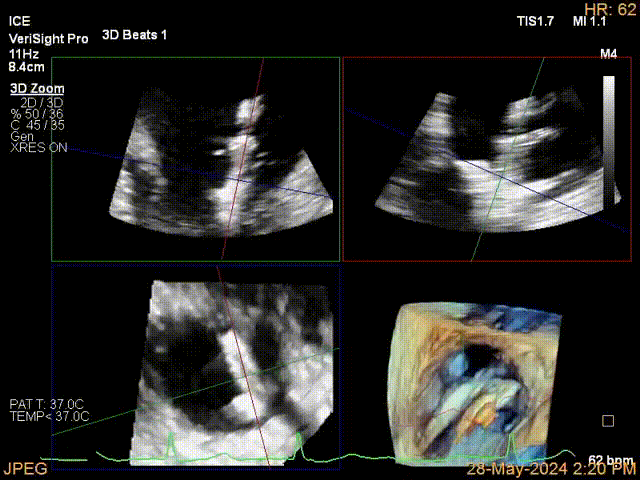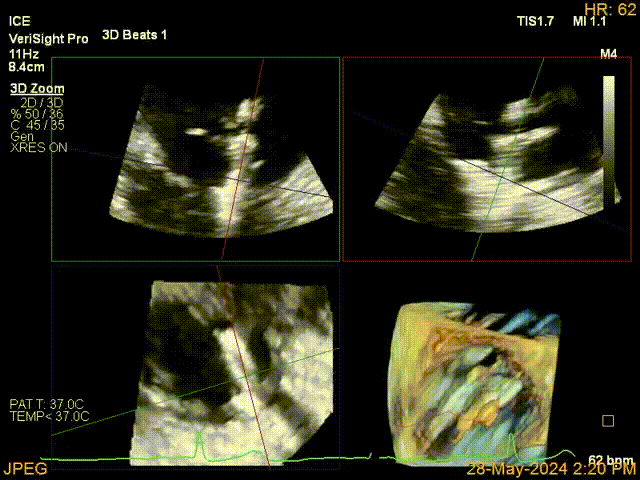
当TEE成像困难时,三维心腔内超声心动图(3D-ICE)可作为备选成像工具。有三种不同的三维心内超声心动图设备可供选择,包括AcuNav Volume (Siemens Healthiness)、VeriSight Pro(Philips)和NuVision(Biosense Webster),每种导管直径和视野略有不同(见图9、视频4和视频5)。3D-ICE可作为经导管三尖瓣不同介入手术(包括TEER和经导管瓣环成形术)中TEE的辅助术中引导。然而,3D-ICE仅在亚太地区(如香港)非常有限的机构可以使用,且导管价格昂贵(4,500至5,500美元)。

随着三尖瓣介入手术的快速发展,高素质的介入超声心动图医师是该领域进一步拓展的关键。因此,对介入超声心动图医师进行专门培训以指导这些手术至关重要。然而,目前亚太地区尚未开发类似的结构化课程,这可能会限制该地区三尖瓣介入手术的发展。发展介入超声心动图技能不仅需要制定结构化课程以确保能力,还需要能够获得新型成像技术,并在亚太地区结构性心脏病专业影像领域加强联系和相互学习。
未来预期
早期三尖瓣临床试验,如TRILUMINATE试验,未能证明对TR进行有创干预可降低死亡率。然而,TRILUMINATE试验表明,患者KCCQ评分和生活质量总体指标有所改善。随着三尖瓣介入治疗临床试验的成熟,需要进一步科学证据来完善患者选择、手术类型(修复与置换)以及干预时机(例如,无症状重度TR、有症状中度TR)(见图10)。右心衰竭的分期尚未明确,未来可作为考虑TR干预指征的替代指标(见图10)。

图10 症状性TR治疗的未来挑战
在治疗TR方面,TEER术和三尖瓣置换术发挥着重要作用。未来,针对特定患者的TR治疗干预措施可能会看到更多联合技术的应用,例如, TEER术与瓣环成形术结合。对于同时患有二尖瓣反流和TR的患者,手术时机、技术和器械选择仍需根据患者的具体情况而定。
电生理学和TR交叉领域仍存在未知领域。与CIED相关的TR引起了越来越多的临床关注。随着不同起搏技术和无导线起搏器的快速发展,与电生理医师密切合作,以确定最佳起搏策略并治疗与CIED相关的TR患者变得越来越重要。在亚太地区,CIED电极拔除术主要用于电极故障或CIED相关感染,很少用于治疗与CIED相关的TR。此外,电极拔除术在减少TR方面的效果报道不一。由于缺乏证据,亚太地区在管理与CIED相关的TR方面尚未形成统一的共识。早期及时发现CIED引起TR可能允许通过手术或经导管引导改变电极位置。从长远来看,在初始和后续右心电极/设备植入时使用术中成像指导,可能有助于最大限度地降低患者发生TR的风险。
结论
TR与显著的死亡率相关。过去十年,三尖瓣介入手术取得了显著进展。亚太地区TR的病理生理机制存在异质性,这需要根据各地区医疗保健和社会经济状况,通过工作场所、社区和人群健康水平等多个层面实施更具针对性的干预手段。随着全球TR临床试验的不断深入,将更深入地了解该疾病的机制、表型、最佳干预时机以及预防右心衰竭的策略。
JACC: Asia编委会

· END ·

