
接上篇,有关AUC和以往指南的不同,以及关于ICD二级预防的推荐,可点击下方链接前沿解析丨孙志军教授解读2025 AUC方案:贴近临床的心脏植入式电子设备适宜性使用标准
心脏性猝死(SCD)一级预防的ICD适宜性标准和具体临床应用情景
心脏性猝死“一级预防”是指患者虽未发生过致命性室速或室颤,但因存在较高猝死风险,提前植入ICD以预防心脏性猝死。
2.1冠状动脉疾病(CAD)患者的ICD植入时机概述
急性心梗后至少等待40天再考虑ICD:
急性心梗后立即植入ICD并未被证实能改善总体生存,反而可能带来额外风险。
研究显示,过早植入ICD(心梗40天内)无法降低全因死亡风险(DINAMIT、IRIS研究结果)。
冠脉血运重建(如搭桥术或支架置入)后等待3个月再评估ICD适应证:
因为血运重建后心功能可能改善,应观察至少3个月再做决定(MADIT II研究)。
特殊情况:
若心梗或血运重建术后早期患者就有明确的起搏器植入指征,同时左室射血分数(LVEF)≤35%,建议直接植入ICD(避免二次手术风险及费用)。
电生理检查(EP检查)的应用:
对于心梗或血运重建术后早期(1个月内)出现非持续性室速,目前没有足够证据推荐常规电生理检查进行风险评估,应个体化决策。
冠状动脉疾病(CAD)患者的ICD植入的适宜性使用标准和具体临床应用场景如下:
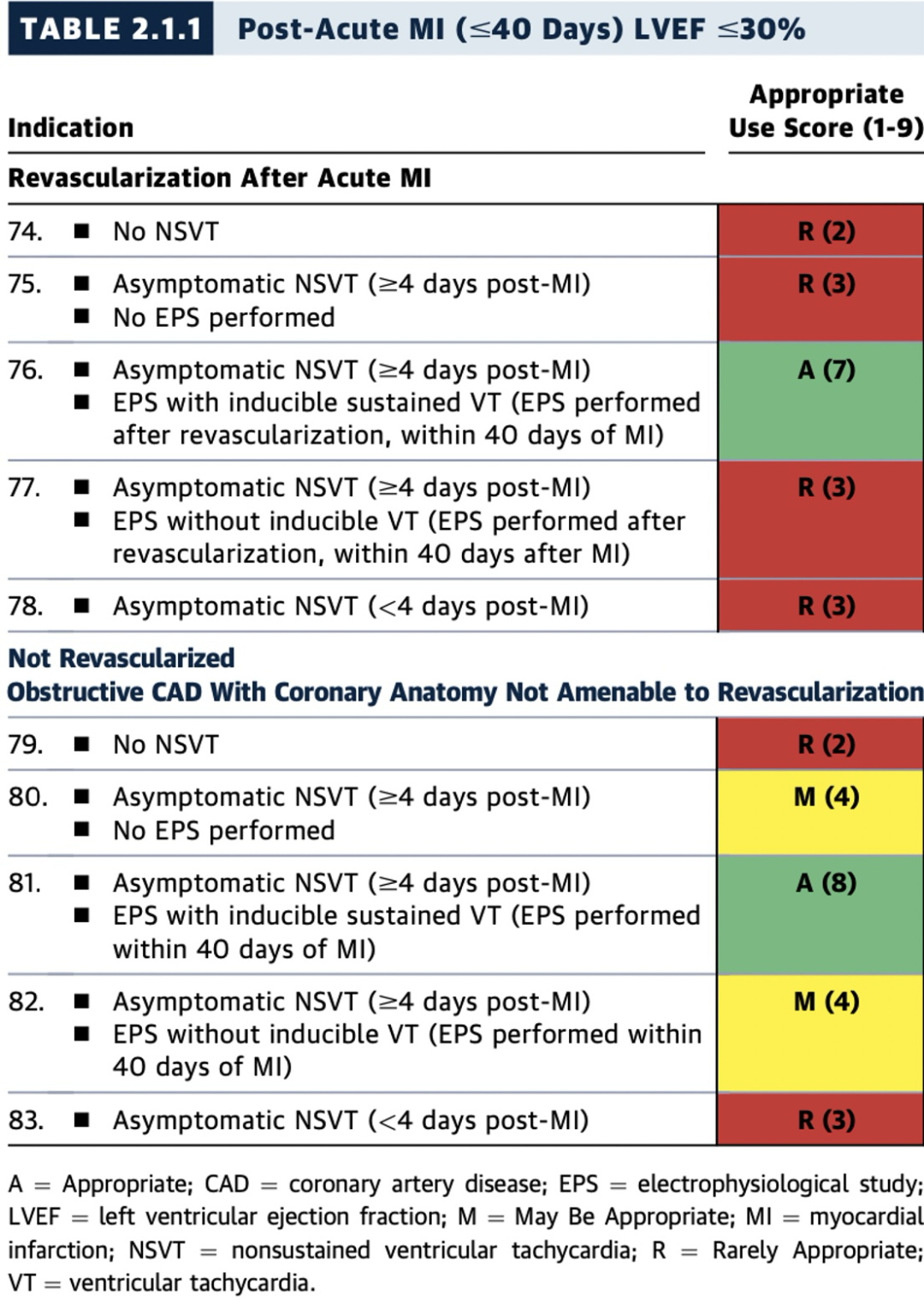
2.1.1 急性心肌梗死(MI)后(≤40天)且左室射血分数(LVEF)≤30%
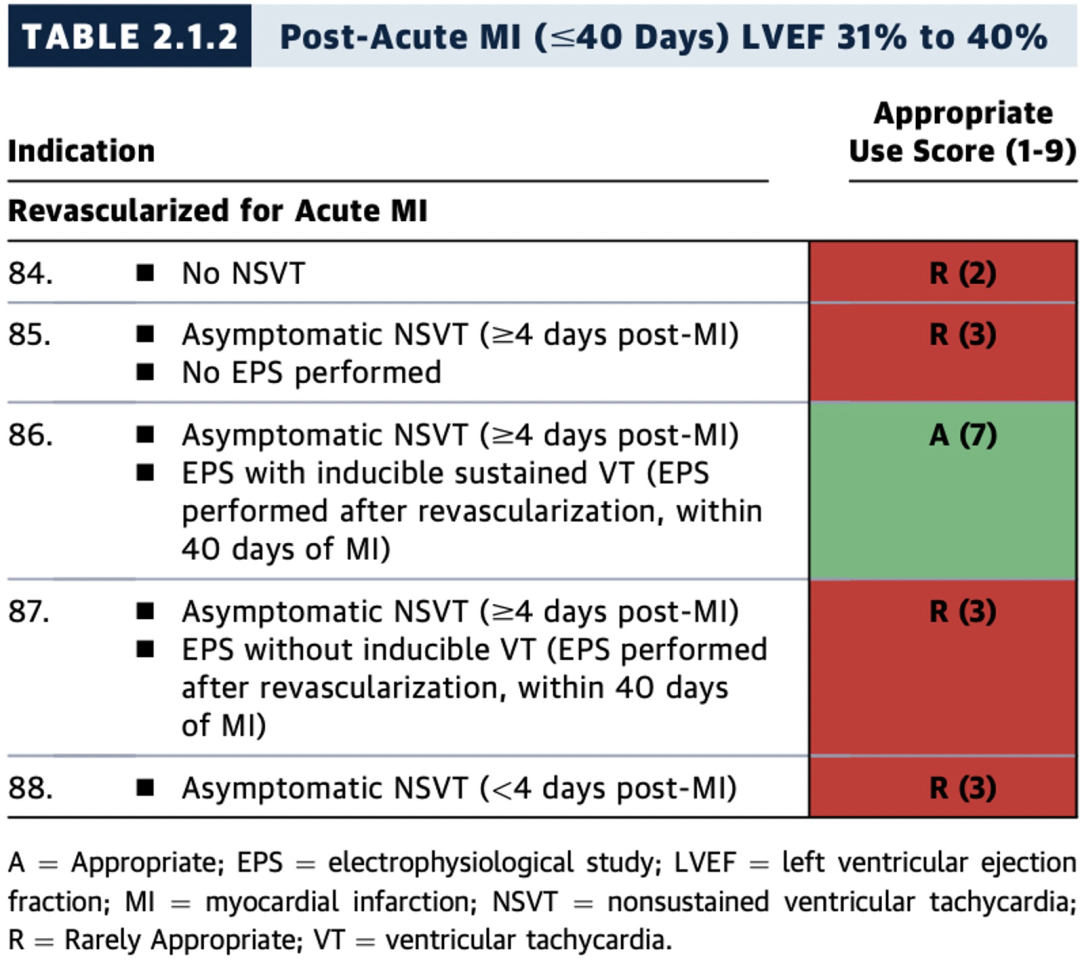
2.1.2 急性心肌梗死(MI)后(≤40天)且左室射血分数(LVEF)31%至40%
重点提示:
表2.1.1至2.1.2中的许多临床情景描述了MI后较短时间段内(≤40天)的情况,但此期间的试验数据较为有限。
MUSTT研究纳入了冠状动脉疾病(CAD)、LVEF ≤40%、无症状的非持续性VT(NSVT)的患者。入组所要求的心律失常事件必须发生于入组前6个月内,且最近一次MI或血运重建术后≥4天。MUSTT研究表明,电生理检查指导的ICD治疗(而非抗心律失常药物)能够降低猝死风险;然而,大部分(>80%)随机入组的患者最近一次MI均发生于入组前1个月以上。因此,由于MI后1个月内入组的患者数量极少,此时间段内电生理检查的临床价值尚不确定。
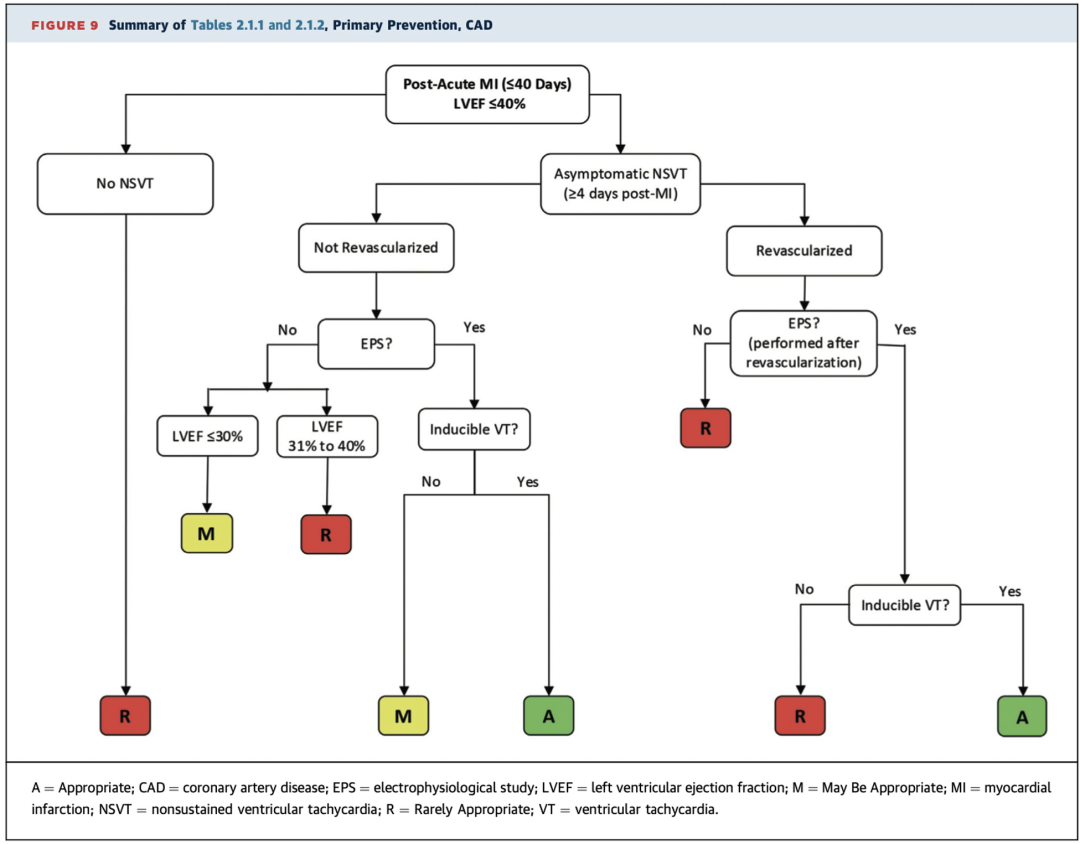
尽管如此,在MI后早期(≤40天)、无症状NSVT发生于MI后≥4天且电生理检查可诱发持续性VT的患者(LVEF≤40%),植入ICD被认为是适宜的(A级推荐)(见表2.1.1至2.1.2,图9)。
在急性MI后血运重建术(≤40天)后,存在无症状NSVT(MI后>4天)且电生理检查可诱发持续性VT的患者(LVEF≤40%),植入ICD被认为是适宜的(A级推荐)(表2.1.1至2.1.2,图9)。鉴于术后极早期进行电生理检查的数据有限,且已有数据表明该阶段NSVT可能是较不特异的未来事件风险因素,因此电生理检查时机应个体化决定。
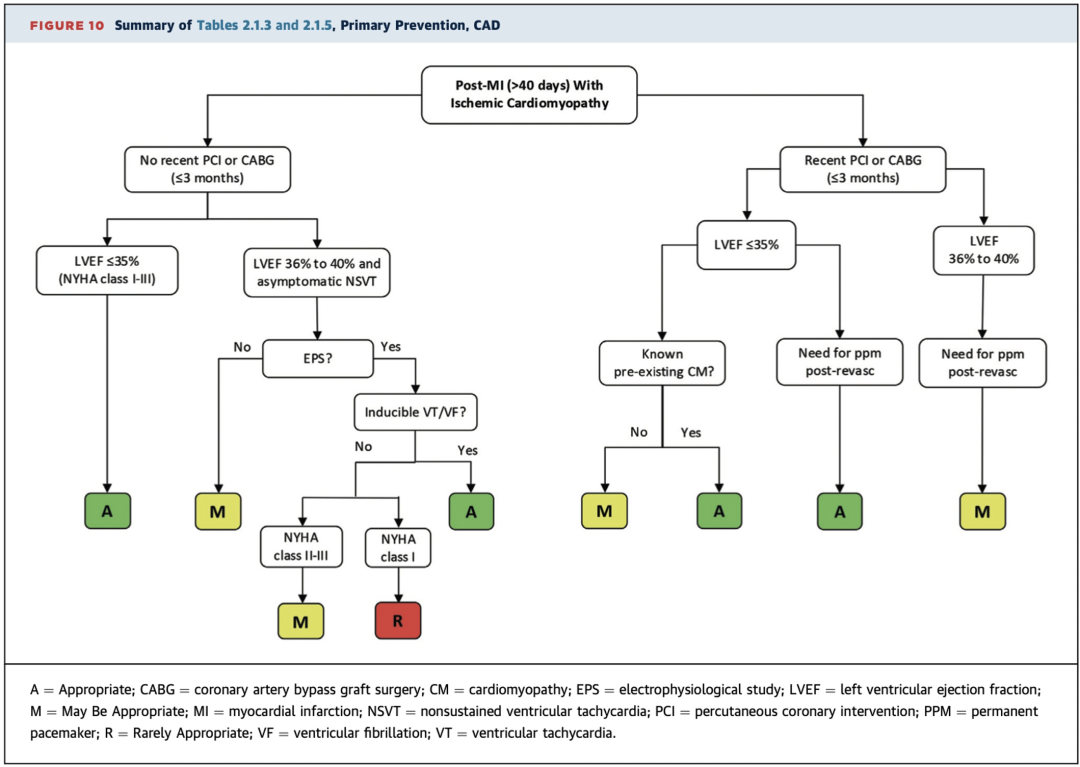
2.1.3 急性心肌梗死(MI)后(≤40天)且左室射血分数(LVEF)≤30%

重点提示:
当患者已有慢性(≥3个月)心肌病且LVEF≤35%,无论病因如何,即使在急性MI后40天内,ICD植入也被评为适宜的(A级推荐)(表2.1.3,图10)。此情景的理由在于心肌病是急性MI之前即已存在的慢性病变,因此LVEF在MI后恢复的可能性较低。
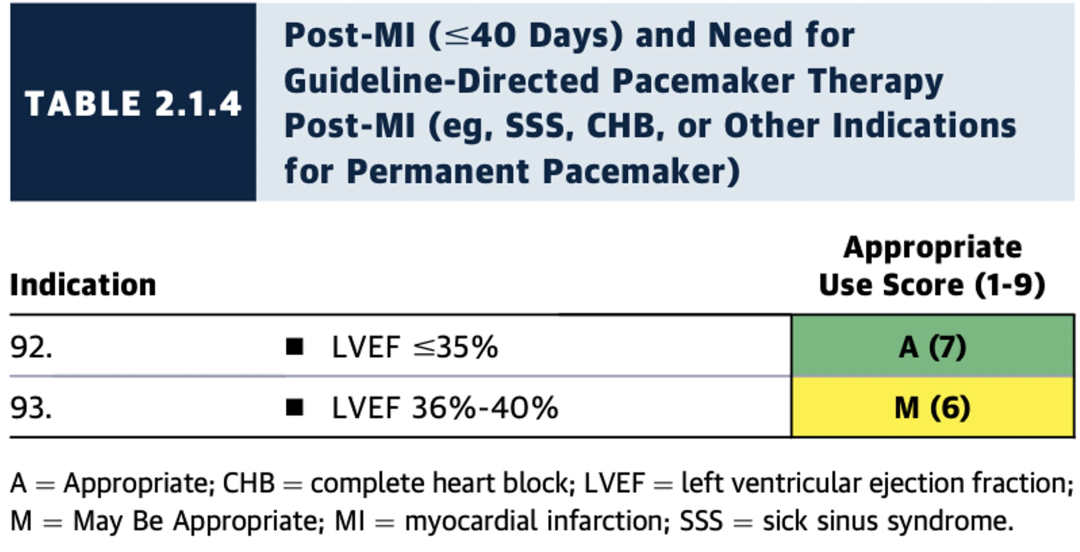
2.1.4 急性心肌梗死(MI)后(≤40天)且存在指南指导的起搏器治疗适应症(例如,病窦综合征、完全性心脏传导阻滞或其他永久起搏器适应症)
重点提示:
LVEF严重降低(≤35%)且患者在MI后早期(≤40天内)或血运重建术后<3个月内需要永久起搏器(PM)植入时,ICD植入被评为适宜的(A级推荐)(表2.1.4至2.1.5,图10)。
尽管这些情景尚未在临床试验中特别提及,但从成本效益和患者安全的角度来看,这样的决定是合理的。如果血运重建术后预计LVEF无明显改善,则3个月后再次手术会使患者面临不必要的风险。当患者在MI后早期(≤40天内)需要起搏治疗时,直接植入ICD也合理,避免了先植入起搏器再于40天后更换为ICD带来的风险和费用。
在REPLACE注册研究中,计划经静脉加装导线用于更换或升级装置的患者并发症发生率高达15.3%。早期直接植入ICD可以避免早期再次手术的额外风险。
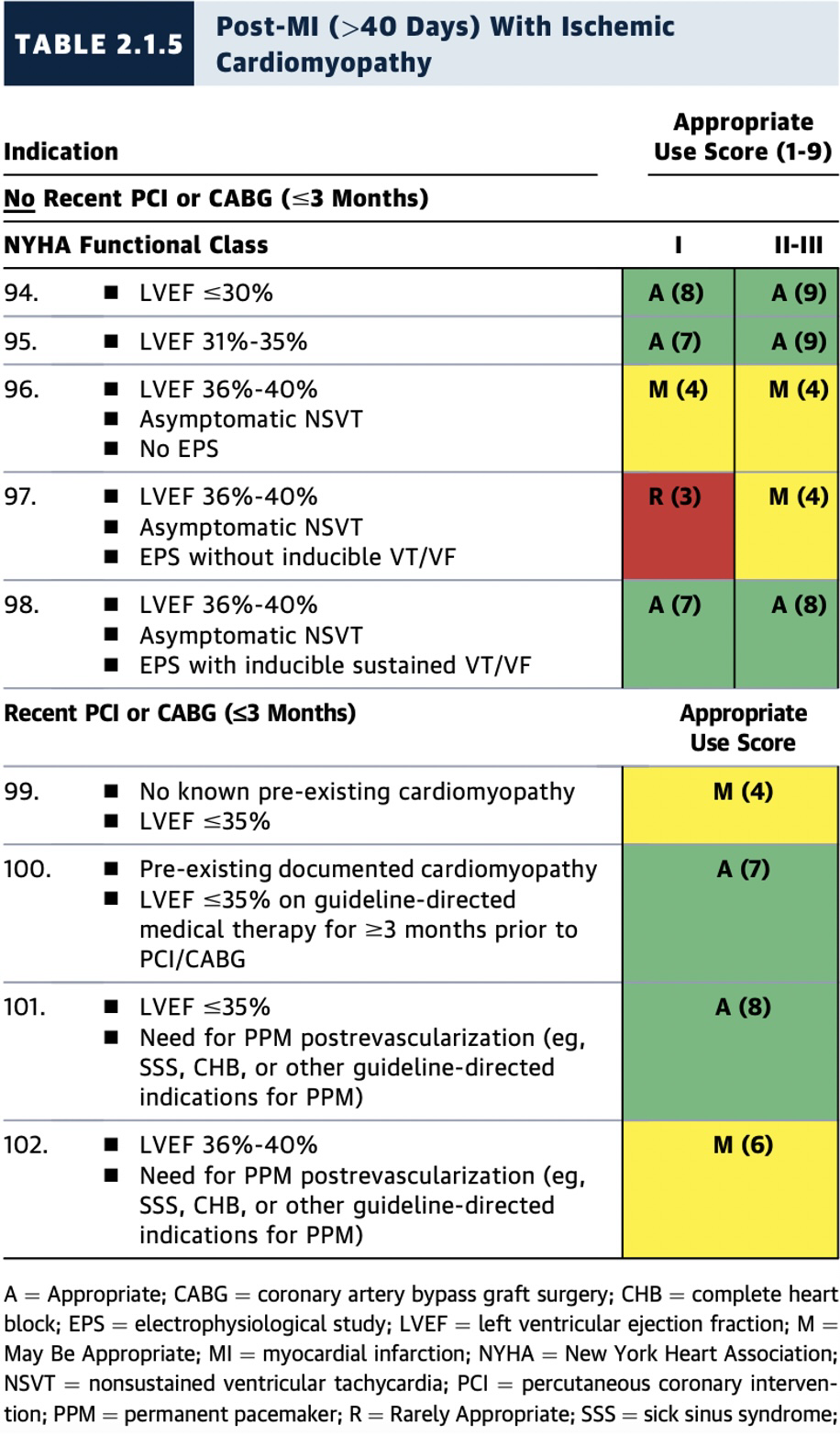
2.1.5 急性心肌梗死(MI)后(>40天)且伴有缺血性心肌病

重点提示:
当近期(≤3个月内)实施血运重建术,且患者在经皮冠状动脉介入治疗(PCI)或CABG前已接受GDMT治疗≥3个月且LVEF≤35%时,专家组评估认为ICD植入也是适宜的(A级推荐)(表2.1.5,图10)。
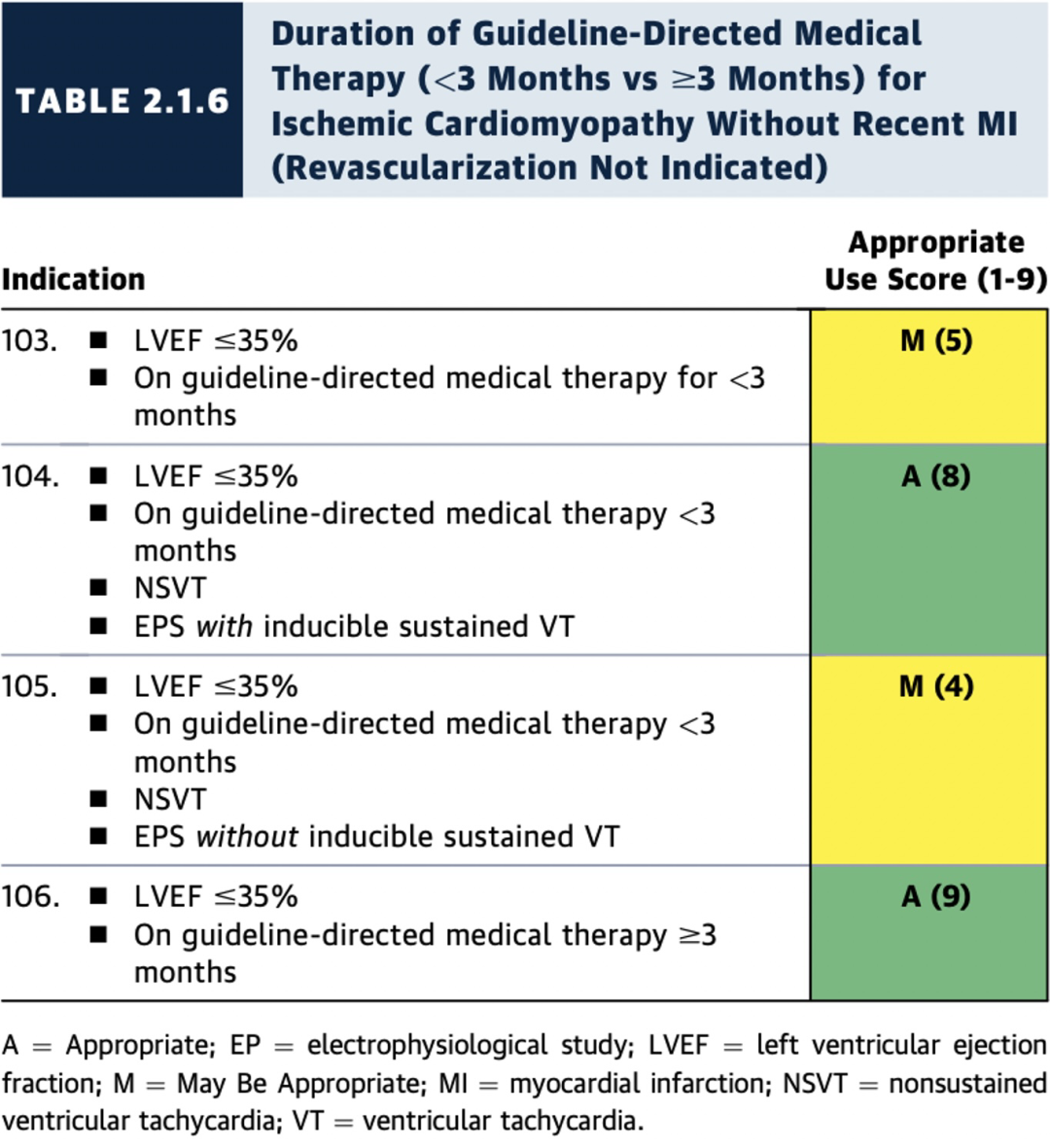
2.1.6缺血性心肌病且近期未发生心肌梗死(无血运重建指征)情况下的指南指导的药物治疗期(GDMT)(分<3个月和≥3个月两种情况)
重点提示:
对于无近期MI的缺血性心肌病,只有在GDMT≥3个月后植入ICD才被视为适宜(A级推荐);
倘若存在NSVT且电生理检查显示可诱发持续性VT则即使GDMT<3个月植入ICD也被视为适宜(A级推荐)(见表2.1.6)。
2.2非缺血性心肌病患者的ICD植入决策及时机概述
所有心肌病患者首选优化药物治疗,这能够显著改善患者左室功能、预后及生存率。新诊断的患者应接受至少3个月的指南导向优化药物治疗(GDMT,包括β受体阻滞剂、ACEI/ARB、醛固酮受体拮抗剂、SGLT2抑制剂或沙库巴曲-缬沙坦)。
若患者在充分优化药物治疗≥3个月后LVEF仍≤35%,考虑植入ICD。
对于年轻患者或具有MRI心肌晚期钆增强(LGE,提示心肌瘢痕)的患者,应高度重视猝死风险,但目前尚缺乏明确证据,仅凭MRI结果无法单独决定ICD植入,仍需综合其他因素。
若非缺血性心肌病患者有明确起搏治疗指征,应优先考虑植入ICD或CRT,而非单纯起搏器,以同时降低猝死风险和改善心功能。
对于一些特殊病因心肌病(如心肌炎、巨细胞性心肌炎、致心律失常性心肌病),患者室性心律失常风险较高,ICD决策应更积极、个体化。
非缺血性心肌病患者的ICD植入的适宜性使用标准和具体临床应用场景如下:
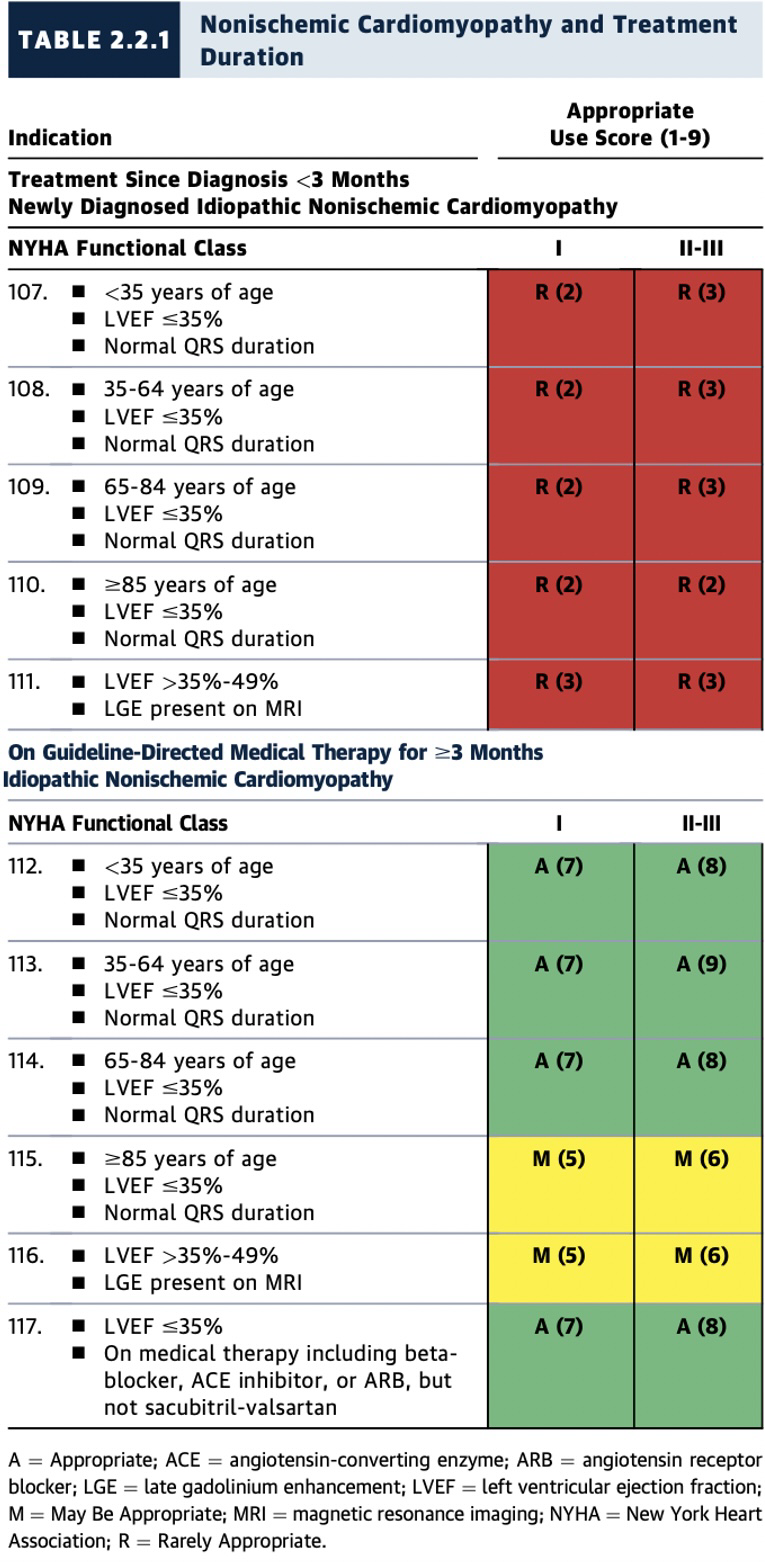
2.2.1 非缺血性心肌病及治疗期间
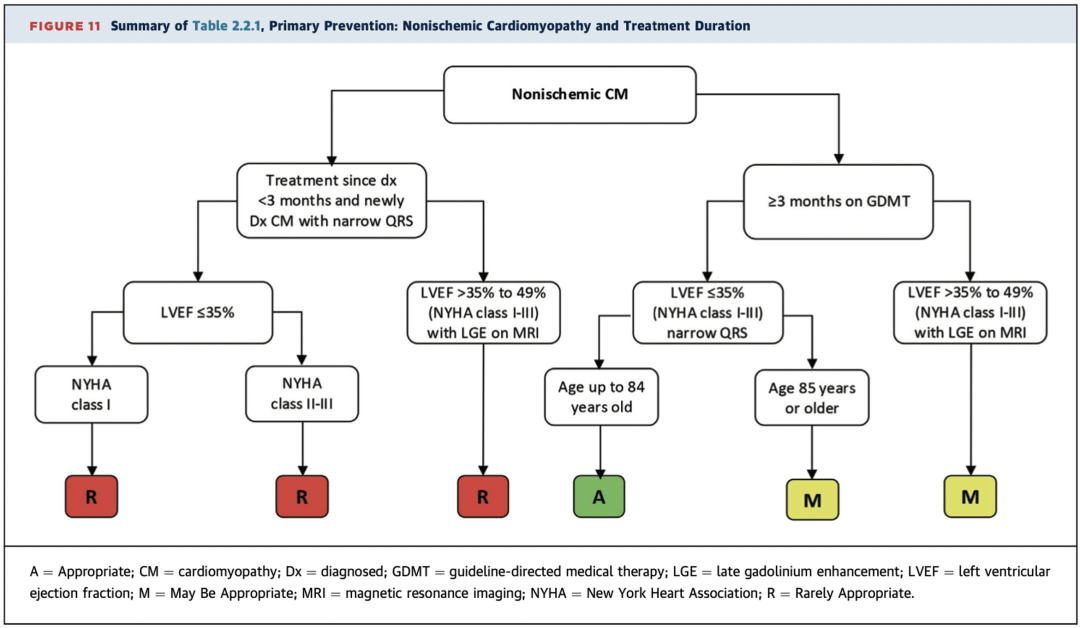
重点提示:
1)、非缺血性心肌病患者接受GDMT治疗≥3个月,若患者年龄<85岁,LVEF≤35%、窄QRS波、NYHA心功能分级I-III级时,植入ICD被评为适宜(A级推荐);若患者年龄≥85岁,则评为可能适宜(M级推荐)(表2.2.1,图11)。
2)、新诊断的非缺血性心肌病患者应先接受一段时间GDMT,以期LVEF改善。在多数情况下,新诊断(<3个月)的心肌病患者(LVEF≤35%)在3个月内植入ICD被认为很少适宜(R级推荐)(表2.2.1,图11)。
2.2.2 非缺血性心肌病且合并瓣膜手术后需起搏治疗

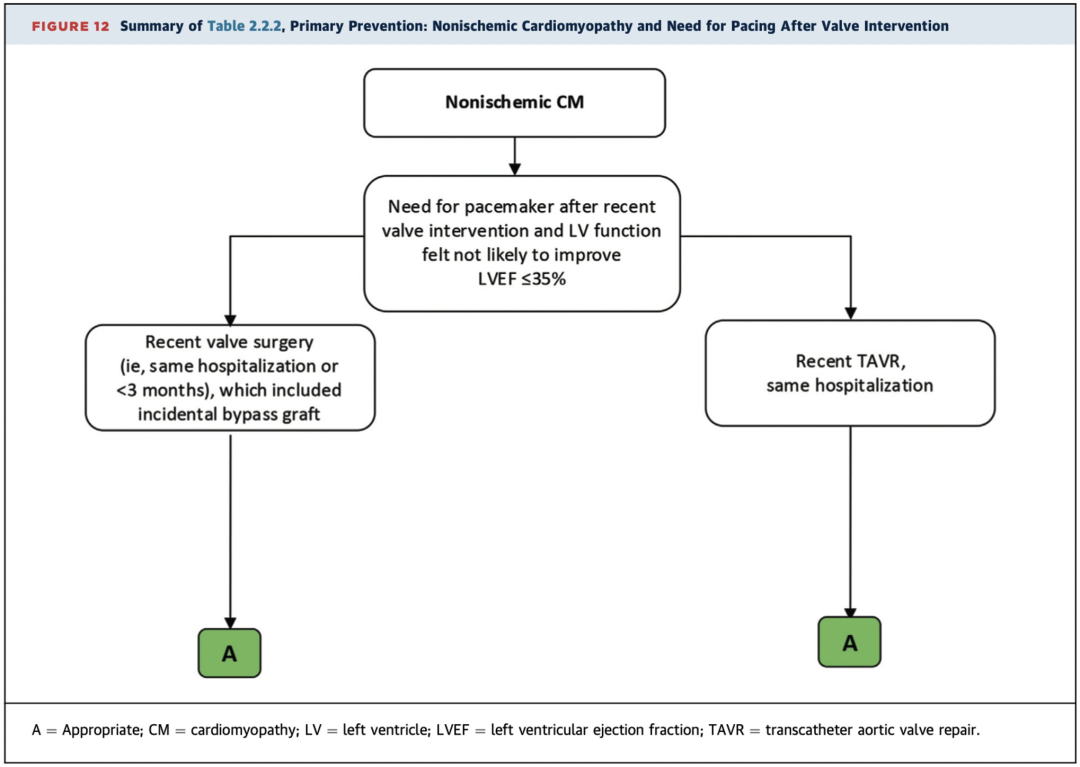
重点提示:
非缺血性心肌病且近期瓣膜手术合并附带冠脉搭桥后需起搏治疗且严重LV功能障碍(LVEF≤35%)预计不会改善的患者,无需GDMT治疗3个月的等待期,应根据临床情况尽早择期植入ICD治疗被评为适宜(A级推荐)(表2.2.2,图12)。
2.2.3 非缺血性心肌病情况下的特定病因


重点提示:
特定病因的非缺血性心肌病,如表2.2.3所述,这些情况在GDMT下左室功能或心律失常基质改善有限。例如,肉芽肿性心肌病、肌强直性营养不良、Chagas病和巨细胞性心肌炎等病因具有恶性心律失常风险极高的特点,专家组评估即使GDMT<3个月,ICD植入亦为适宜(A级推荐)(表2.2.3,图13)。
2.3遗传性疾病伴有结构性心脏病的ICD植入标准和临床场景
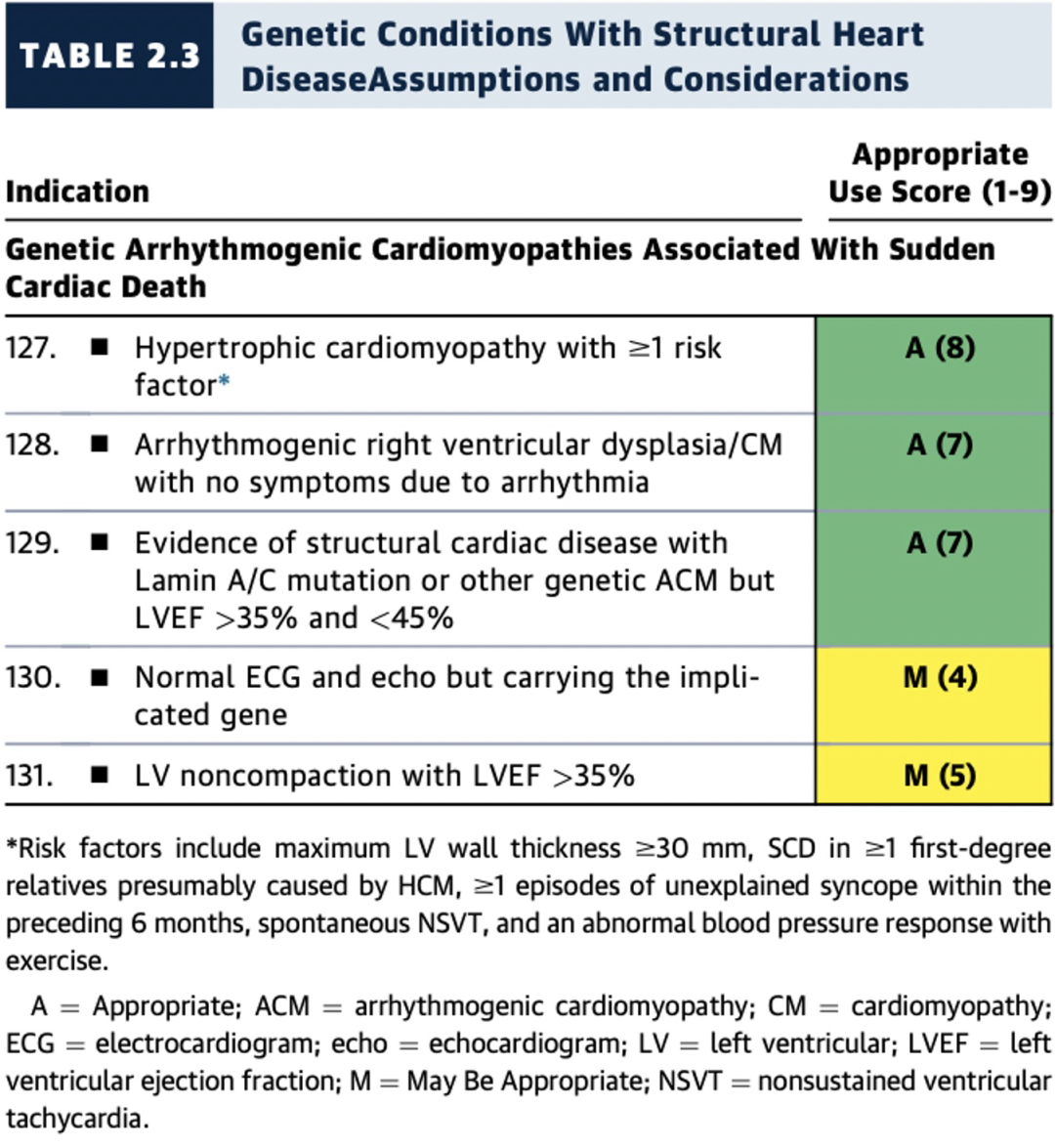
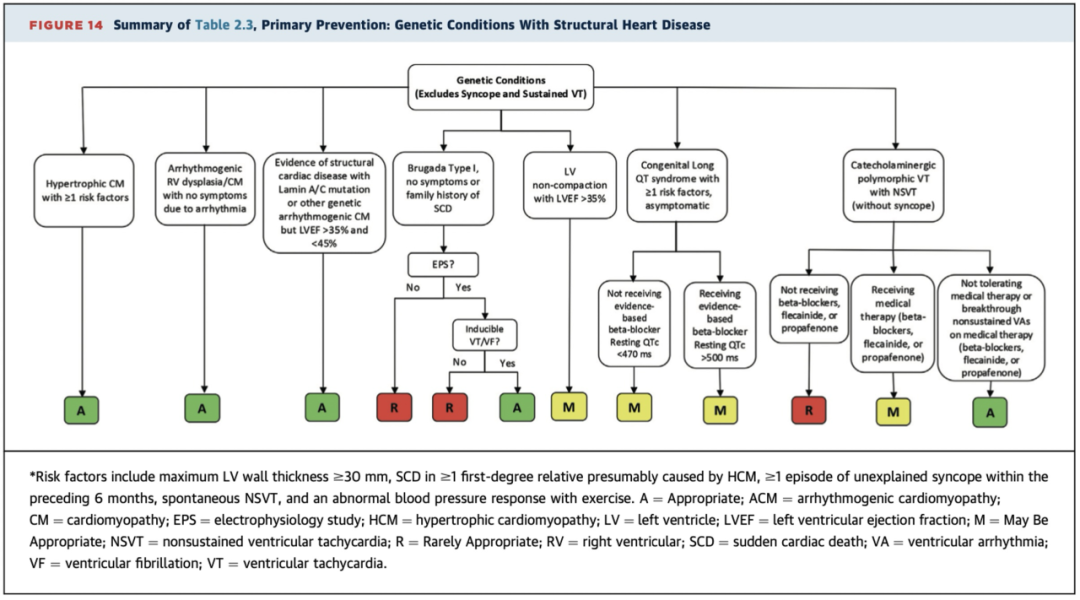
风险因素包括:左室壁厚≥30毫米,家族中≥1位一级亲属因肥厚型心肌病(HCM)而发生心脏性猝死(SCD),过去6个月内≥1次无法解释的晕厥,间歇性非持续性室性心动过速(NSVT)和运动时血压异常反应。
重点提示:
遗传性致心律失常性心肌病即使LVEF>35%且<45%时,ICD植入也是适宜(A级推荐)(表2.3和图14)
2.4无结构性心脏病的遗传性疾病ICD植入标准和临床场景
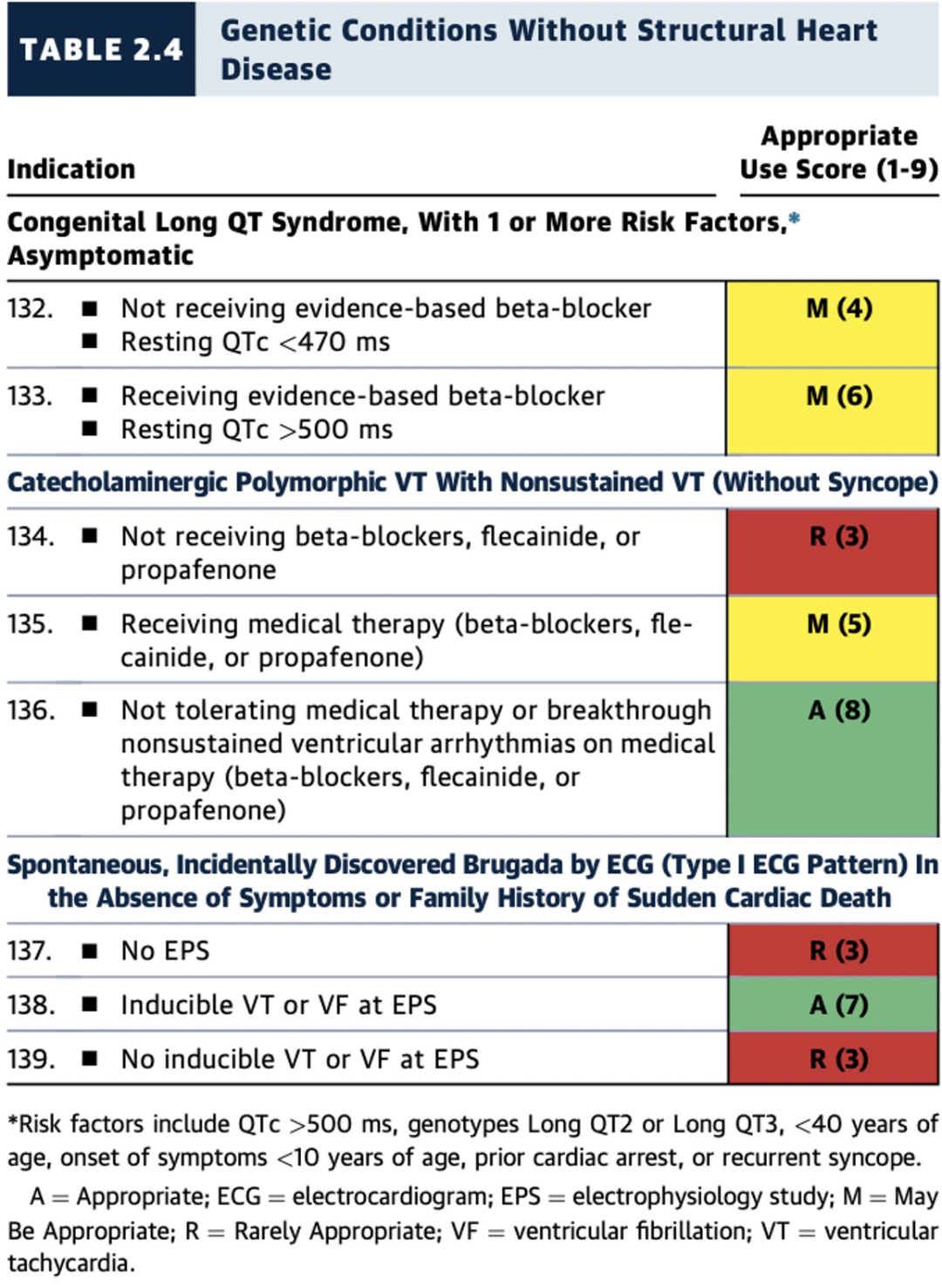
风险因素包括QTc >500毫秒,Long QT2或Long QT3基因型,<40岁,症状出现年龄<10岁,曾发生过心脏骤停或反复晕厥。
重点提示:
遗传性疾病病不伴有心脏结构异常者,无法耐受药物治疗或EPS诱发VT/VF情景下,ICD植入也是适宜(A级推荐)或可能适宜(M级推荐)(表2.4和图14)
未完待续
下期将继续带来2025年AUC方案关于“合并特殊条件下的ICD一级预防植入决策”的内容,欢迎持续关注
转自:世说心语之谈古论今